https://doi.org/10.22319/rmcp.v14i3.6255
Revisión
Proteína Bm86 y su potencial uso como vacuna contra garrapatas en el ganado bovino. Revisión
Dulce María Galván Arellano a
Patricia Vieyra Reyes a
Roberto Montes de Oca Jiménez a
Jaime Ortega Lopez b
Saúl Gabriel Martínez Arzate c
Bruno Rivas Santiago d
Juan Carlos Vázquez Chagoyán a*
a Universidad Autónoma del Estado de México. Centro de Investigación y Estudios Avanzados en Salud Animal, Facultad de Medicina Veterinaria y Zootecnia. Autopista Toluca-Atlacomulco Km 15.5, San Cayetano de Morelos, Toluca, México.
b Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAV), México.
c Universidad Tecnológica del Valle de Toluca, México.
d Biomedical Research Unit. Zacatecas, México.
*Autor de correspondencia: jcvazquez@uaemex.mx
Resumen:
Las infestaciones de garrapatas representan una gran dificultad para la producción de ganado bovino en países tropicales y subtropicales alrededor del mundo. Las formas tradicionales de combate a esta plaga son químicos (acaricidas) y manejo integral de pastizales. Sin embargo, estos métodos no han logrado controlar de manera contundente la presencia de este ectoparásito. Lo anterior ha llevado a la búsqueda de vacunas que permitan el control de estos parásitos. Actualmente, se cuenta con inmunógenos que contienen el antígeno intestinal Bm86 de Rhipicephalus microplus, los cuales han demostrado ser una alternativa efectiva, al reducir las poblaciones de garrapatas y el uso de acaricidas sintéticos. No obstante, el polimorfismo de este locus en garrapatas de distintas zonas geográficas representa una limitante en su efectividad. Se han realizado un número importante de investigaciones acerca del gen Bm86 como antígeno vacunal, por lo que, en este documento, se presenta una actualización de las investigaciones realizadas con este antígeno y su potencial uso como control inmunológico para reducir las infestaciones de garrapatas en el ganado bovino.
Palabras clave: Bovino, Bm86, Garrapatas, Rhipicephalus microplus, Vacunas.
Recibido: 07/06/2022
Aceptado: 16/03/2023
Introducción
El control inmunológico de garrapatas en el ganado bovino, en comparación con el químico, tiene la ventaja de ser una estrategia relativamente económica sin impacto ambiental. Contribuye a prevenir el desarrollo de resistencia a los acaricidas, ya que cuando estos se usan de manera combinada con vacunas a base de la proteína recombinante Bm86 (rBm86), se puede reducir la periodicidad de su aplicación. Adicionalmente, tiene la capacidad de controlar diversas especies de garrapatas y contribuye a la prevención de la transmisión de los agentes causales de enfermedades como la babesiosis y la anaplasmosis bovinas(1). La primer vacuna propuesta contra garrapatas se desarrolló a partir del antígeno Bm86 presente en células epiteliales del intestino de R. microplus(2,3) cuya función biológica está asociada a mecanismos de endocitosis(1,2,4). El éxito de esta vacuna radica en que induce una reducción del número de organismos que completan su ciclo de vida después de alimentarse de animales vacunados, e incluso reduce la fertilidad de la población de garrapatas sobrevivientes(5). El antígeno Bm86 ha sido probado en campo con un éxito aceptable, y está disponible comercialmente bajo cuatro marcas: Gavac® de Cuba, TickGuard-Plus de Australia, Go-Tick de Colombia y Bovimune Ixovac® de México(6,7). La recomendación general es que se usen de manera combinada con ixodicidas, lo cual puede reducir significativamente la necesidad del uso de estos últimos. No obstante, las vacunas pueden tener una eficacia variable que depende del polimorfismo del gen Bm86 en las poblaciones abiertas de garrapatas, lo cual puede también tener un efecto negativo en la estrategia de uso combinado vacuna-ixodicidas(8). Lo anterior, demuestra la necesidad de continuar con investigaciones del gen Bm86 para desarrollar vacunas con un mayor grado de eficacia. Por lo anterior, el presente escrito tiene por objetivo presentar un panorama actual acerca de las características del antígeno Bm86 y su empleo como vacuna en el ganado bovino.
Proteína Bm86
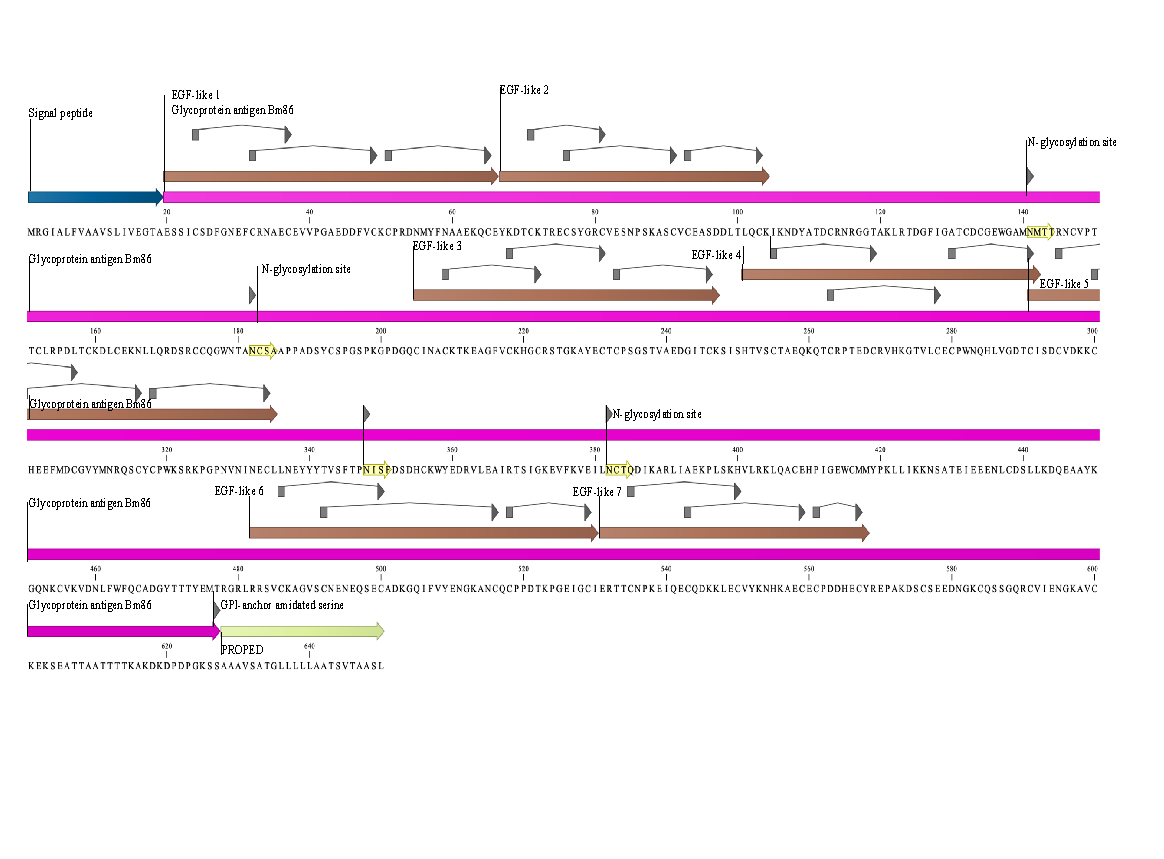
La proteína Bm86 es una glicoproteína identificada y aislada a partir de células epiteliales del intestino de garrapatas (Rhipicephalus microplus), cepa Yeerongpilly(9). Contiene 650 aminoácidos y un peso molecular predicho de aproximadamente 80 kDa(2,4). Se reconocen tres sitios de función: 1) el péptido señal N-Terminal (1-19aa) que es la cadena que aparece primero cuando se sintetiza la cadena de polipéptidos y contiene la información sobre la eficiencia de secreción, ruta y destino de la proteína, 2) el antígeno o glicoproteína Bm86 (20-627 aa) que es propiamente la cadena polipeptídica de la proteína madura después del procesamiento, 3) un propéptido (628-650aa), que es la parte de la proteína que se escinde durante la maduración o activación. Se sabe que la proteína madura contiene una región transmembrana hidrofóbica que abarca 23 aa ubicada en la región del extremo C-terminal, el resto de la proteína presenta un alto potencial hidrofílico. La característica principal de la secuencia proteica es el patrón repetido de 6 residuos de cisteína, lo que sugiere la presencia de diversos dominios de tipo EGF (Epithelial Growth Factor) o factor de crecimiento epitelial (Figuras 1 y 2)(2,10–12).
Figura 1. Estructura primaria de la proteína Bm86
Se muestran: el péptido señal (flecha color azul); dominios de tipo Factor de Crecimiento Epitelial (EGF- flechas color marrón); el anclaje glicosilfosfatidilinositol (GPI-Flecha color verde); Cisteínas para la formación de puentes disulfuro (cajas-punta de flecha grises); sitios de N-glicosilación (puntas de flecha aisladas).
Figura 2: Modelo 3D de la proteína Bm86
La proteína Bm86 está formada por una cadena polipeptídica de 650 aminoácidos que contiene un péptido señal (1-19), varios dominios de tipo Factor de Crecimiento Epitelial (EGF) (20-600) y se encuentra asociada a la membrana mediante un anclaje GPI en el C-Terminal. En la figura se muestra el modelo 3D generado por Alpha-Fold, obtenido de la base de datos Uniprot (https://www.uniprot.org/uniprotkb/P20736/entry#structure) y visualizado con ChimeraX (https://www.cgl.ucsf.edu/chimerax/).
Polimorfismo de Bm86
Se han reportado variaciones genéticas discontinuas en el gen Bm86, presentes en distintas poblaciones de garrapatas de R. microplus(13,14). A dos o más de estas variantes comunes en una población natural se le denomina polimorfismo (del griego, muchas formas)(15). Se ha comparado la secuencia del gen Bm86 de tres cepas de referencia (Yeerongpilly, Australia y Camcord de Cuba: éstas tienen secuencias de aminoácidos idénticas excepto por el residuo 111, que en la cepa Camcord es isoleucina y en la australiana treonina)(16,17). Así mismo, en varios estudios se ha observado que en algunas regiones genéticas, la gran mayoría de las cepas presentan una serie de mutaciones (residuos 89, 109, 142, 206, 210, 226, 248, 257 y 272) que están conservadas en las cepas de tierras continentales de América pero que difieren de las cepas de referencia (Cuadro 1)(16,17).
En Argentina fue clonado el gen Bm86 y lo denominaron Bm95 (genbank con número de acceso AF150891.2), guarda casi las mismas variantes que los genes de América del sur y de las texanas mencionadas anteriormente(18). Por otro lado, entre las cepas mexicanas se han encontrado variaciones de 3.1-7.4 % en los nucleótidos de la proteína Bm86, encontrando 145 polimorfismos puntuales a lo largo del gen(19). Del mismo modo, en un estudio realizado en Tailandia, secuenciaron a Bm86 a partir de 29 muestras de garrapatas, obtuvieron similitudes entre el 91.5-97.0 % entre cepas tailandesas y la secuencia de referencia (Yeerongpilly)(20). De acuerdo al autor, el análisis filogenético reveló patrones geográficos entre las secuencias de Bm86 de Tailandia, clasificándose en 5 o 9 grupos en función de las secuencias de nucleótidos o aminoácidos. Lo anterior contrasta con lo reportado en México donde los haplotipos no se limitan a una región, lo cual podría explicarse a la ocurrencia de flujo genético entre diferentes regiones, quizá debido a la movilidad de animales infestados que redistribuyen los genotipos(19).
Cuadro 1: Análisis comparativo de secuencias conservadas de aminoácidos en el gen Bm86 de cepas de Texas, Sudamérica y del gen Bm95 (derivado de una cepa argentina) que difieren de la cepa Yeerongpilly
Posición del residuo de aminoácido en el antígeno Bm86 en la cepa Yeerongpilly | Bm86 (Texas) (a) | Bm86 (Sudamérica) (b) | Bm95 (Argentina) (c) |
17 | + | Nd | - |
89 | + | + | + |
95 | - | - | + |
109 | + | + | - |
142 | + | + | + |
206 | + | + | + |
210 | + | + | + |
226 | + | + | + |
248 | - | + | - |
251 | + | - | + |
257 | + | + | + |
272 | + | + | + |
334 | - | Nd | + |
358 | + | Nd | + |
365 | - | Nd | + |
400 | + | Nd | + |
444 | + | Nd | + |
498 | + | Nd | + |
502 | + | Nd | + |
507 | + | Nd | + |
560 | + | Nd | + |
568 | + | Nd | + |
570 | - | Nd | Codón de término |
593 | - | Nd | |
597 | + | Nd | |
605 | + | Nd | |
610 | + | Nd | |
624 | + | Nd | |
650 | Codón de término | ¿Codón de término? |
Tomado de Martínez-Arzate:(21). Únicamente se muestran las posiciones de los aminoácidos donde se presentan mutaciones de las cepas analizadas en relación con el antígeno originalmente clonado de Bm86 (Yeerongpilly). +, existe una mutación puntual que modifica el aminoácido, -, no presenta la mutación en ese sitio, Nd= no analizado por los autores de la publicación. a) (16), b) (17), c) Genbank con número de acceso AF150891.2. Las secuencias se analizaron con el programa Mega 4(22).
La construcción de un cladograma con algunas secuencias del gen Bm86 obtenidas de reportes disponibles en GenBank, permite observar que existe un gran polimorfismo genético en especímenes de diferentes regiones del mundo (Figura 3). El cladograma se realizó utilizando el algoritmo Neighbor-joining, su arreglo muestra la dirección evolutiva y la relación de secuencias del gen Bm86. Se pueden distinguir tres clados principales A, B y C), cada uno de los cuales presenta un arreglo polifilético. Así mismo, un ancestro común, parece dar lugar al out grup formado por la secuencia única de R. appendiculatus y a las distintas ramificaciones que forman el clado A, en él se observan las dicotomías terminales: China-Yeerongpilly (cepa vacunal australiana TickGARD®) y Mozambique-XM, además de un par de secuencias de terminales únicas, correspondientes a secuencias de Texas. Una de las ramificaciones del ancestro común para todas las secuencias también da origen al putativo ancestro para los clados B, C y para la única terminal suelta correspondiente a una de los aislados mexicanos, y que se acomoda en distinta dirección evolutiva a los clados B y C. En el clado B se observan terminales únicas para 3 de las secuencias mexicanas y una dicotomía para 2 de las secuencias Texanas. En el clado C, se observan las dicotomías Zapata- México y Texas-Texas, además de terminales únicas como Zapata 5, Zapata 1 y Argentina. A pesar de que algunas ramas están soportadas por valores de bootstrap relativamente bajos, el arreglo polifilético del cladograma contribuye a explicar el polimorfismo del gen Bm86 qué podría tener un impacto directo en la eficacia de la vacuna comercial en México, además, reportes para el gen Bm86 mexicanos y texanos muestran relaciones relativamente cercanas, lo cual podría deberse a la relación comercial de ganado y a la migración natural de animales silvestres entre ambos países(16).
Figura 3: Cladograma Neighbor-joining del gen Bm86 de Rhipicephalus microplus
El cladograma, muestra la relación filogenética entre diferentes secuencias del gen Bm86. La cepa homóloga a Bm86 (Ra86-2), de Rhipicephalus appendiculatus se utilizó como grupo externo. Los números en los nodos indican valores de bootstrap. El porcentaje de soporte de arranque de 10,000 pseudo-réplicas se muestra junto a las ramas, que se basan en distancias evolutivas calculadas con Jukes-Cantor. Los análisis evolutivos se realizaron en MEGAX(22).
Vacunas comerciales
Las vacunas contra garrapatas comenzaron a desarrollarse alrededor de la década de 1980, cuando los animales eran inmunizados con proteínas de extractos crudos de hembras semirepletas(23,24). Se observó que las proteínas afectan el intestino medio de la garrapata y causan daños permanentes tanto en células epiteliales como en membrana basal. Lo cual produce efectos negativos en el metabolismo, sistema digestivo y rendimiento reproductivo de las garrapatas(23,24). En este contexto, la proteína de interés fue aislada del intestino medio e identificada como una glicoproteína de membrana, que fue purificada, caracterizada y nombrada Bm86(9).
Con base en lo anterior, las primeras vacunas contra las garrapatas del ganado se registraron entre 1993 y 1997 en América Latina (Gavac®) y Australia (TickGARD®)(4,6,25). La vacuna TickGARD® fue desarrollada por la industria GCSIRO (Common Wealth Scientific and Industrial Research Organization) en colaboración con Biotech Australia Pty. Ldt. saliendo al mercado en 1994 por Hoechst Animal Health. Para su elaboración aislaron el gen de la proteína Bm86 del intestino de la garrapata Rhipicephalus microplus y lo clonaron en Escherichia coli(26). En 1995 expresaron Bm86 en Pichia pastoris y salió al mercado como TickGARD®PLUS(27). La razón fue que, Bm86 demostró una mejor expresión en P. pastoris debido a los restos de glucano agregados durante la maduración de proteínas en la levadura (revisado por Willadsen en un informe de la industria)(28).
En los primeros cuatro años posteriores a su lanzamiento, se convirtió en el tratamiento más vendido en ese país. Sin embargo, cerca del final de la década cesó su venta debido a la separación y cierre de las empresas encargadas de su producción. Años más tarde fue reintroducida al mercado por Intervet Australia Pty. Ltd., pero después de un corto periodo fue cesada su venta pública(6).
Los resultados de la aplicación de la vacuna TickGARD® (Tabla 2) fueron reportados por primera vez en 1995, obteniendo una importante reducción en el empleo de acaricidas y una disminución del 72 % en la capacidad reproductiva de las garrapatas(29). En otro estudio se reportaron reducciones del 56 % en el número de garrapatas en campo durante una generación y una reducción del 72 % en la capacidad reproductiva de hembras R. microplus en condiciones de laboratorio(30). Por otro lado, el grupo cubano desarrollo en el Centro de Ingeniería Genética y Biotecnología de la Habana Cuba por Heber Biotec S. A., la vacuna Gavac®, que fue registrada en Cuba en 1993, en Colombia y República Dominicana en 1994 y en Brasil, Paraguay y Bolivia en 1995(6,31,32). Emplearon la proteína rBm86 expresada en la levadura metilotrófica Pichia pastoris, porque se ha demostrado que es un huésped adecuado para la producción industrial de proteínas heterólogas(33). Se estimó que la cantidad de rBm86 secretada por P. pastoris es de aproximadamente 1.5-2.0 g/L, superior a la obtenida en fermentaciones de E. coli(34,35). Su esquema de vacunación consta de tres aplicaciones primarias de 2 ml cada una (100 μg rBm86), vía intramuscular (IM), con intervalos de tres semanas en cada aplicación, con un refuerzo cada seis meses(36). La efectividad de la vacuna se ha determinado empleando varios parámetros tales como: el número de hembras adultas; el efecto sobre el peso de las garrapatas semirepletas; la supervivencia de las garrapatas hembra adultas; el número de huevos y su fertilidad(32).
Por ejemplo, en un estudio controlado se evaluó la efectividad de la vacuna Gavac® contra diferentes cepas de R. microplus y en diferentes razas de ganado, se encontró que la eficacia era >50 %(32). La vacuna también ha demostrado ser eficaz en el control de infestaciones artificiales de B. annulatus, B. decoloratus y cepas de B. microplus, ya sean sensibles o resistentes a los productos químicos en Australia, África, América e Irán (Cuadro 2)(3). Además, en un análisis de costo-efectividad, la vacuna demostró una reducción del 60 % en el número de tratamientos acaricidas, así como el control de las infestaciones por garrapatas y la transmisión de babesiosis, lo que resultó en un ahorro de 23.4 dólares por animal/año(37). De manera similar, en ensayos de campo controlados en Cuba, se vacunaron 588,573 vacas lecheras, lo que mostró una reducción del 87 % en el uso de acaricidas durante 8 años (1995-2003)(38).
Además, en un estudio inocularon bovinos con TickGARDPLUS® y Gavac®, y desafiaron a los animales con una cepa brasileña “Campo Grande” de R. microplus, los resultados arrojaron una efectividad de 46.4 y 49.2 %, respectivamente(39). Considerando lo anterior, pueden observarse variaciones en la eficacia de las vacunas, lo cual puede explicarse debido a la diversidad genética (polimorfismo) de las poblaciones de garrapatas y factores del hospedero(8). Algunos autores sugieren que la variación de la secuencia del locus de Bm86 (> 3 % en la secuencia de aminoácidos) es una de las principales razones para que en ciertas poblaciones de R. microplus las vacunas comerciales tengan una eficacia limitada(13).
En el año 2018 se desarrolló en México una vacuna a partir del germoplasma de la cepa “Media Joya” de R. microplus, fue clonada en el vector de expresión Pichia pastoris. La vacuna se registró con el nombre de Bovimune Ixovac® (Lapisa S.A., Guadalajara, México) con registro SAGARPA B-2083-03, y está siendo empleada en el estado de Guerrero donde existen poblaciones de garrapatas multirresistentes(40). Su esquema de vacunación consiste en tres aplicaciones primarias de 2 ml cada una de ellas (120 ± 20 μg de rBm86), IM, en las semanas 0, 4 y 7, posteriormente revacunación semestral (a una sola dosis)(41).
El tratamiento ha permitido mantener infestaciones menores a 10 garrapatas por animal, y aminorar la aplicación de baños garrapaticidas de 14 a 3 anuales, además de reducir la fertilidad en un 86 % de las garrapatas hembra(42). Hasta el momento no hay más información publicada sobre la secuencia y efectividad de la vacuna en otras regiones de México.
De igual forma, en Colombia el laboratorio LIMOR elaboró la vacuna Go-Tick contra R. microplus con registro del Instituto Colombiano Agropecuario Nº 6774-BV, a base del antígeno Bm86 extraído de larvas de garrapatas. La misma vacuna se comercializa bajo la marca Tick-Vac por el laboratorio TECNOQUÍMICAS. Su esquema de vacunación consta de tres vacunaciones iniciales de 2 ml cada una, vía subcutánea o IM, en los días 0, 20 y 60, posteriormente revacunación semestral(43). En una prueba de campo en Colombia, la vacuna mostró un efecto combinado de 80 % de protección(7). Mientras que, en estudios clínicos de campo, ha demostrado una protección del 64 al 96 %, reduciendo la carga parasitaria en sistemas de producción ubicados en diferentes agroecosistemas nacionales de Colombia(44).
Cuadro 2: Resumen de las eficacias de las vacunas que contienen el antígeno Bm86 contra diferentes especies de garrapatas
Especie de garrapata (cepa) contra la que fue probada la vacuna | Vacuna | Eficacia (%) | Referencias |
R. microplus (Yeerongpilly) | Gavac® | 75 | (45) |
R. microplus (Cenapa) | Gavac® | 84 | (45) |
R. microplus (Tuxpan) | Gavac® | 51 | (45) |
Boophilus annulatus | Gavac® y TickGARD® | > 99.9 | (46) |
R. microplus (Campo Grande) | TickGARDPLUS® | 46.4 | (39) |
R. microplus (Campo Grande | Gavac® | 49.2 | (39) |
R. microplus (Colombia) | Go-Tick | 80 | (47) |
R. microplus (Media Joya) | Bovimune Ixovac® | 86 | (42) |
(%), Eficacia expresada en la reducción del número de garrapatas hembra adultas por cabeza de ganado, reducción de oviposición y de fertilidad.
Respuesta inmune humoral contra el antígeno Bm86
Las vacunas contra garrapatas estimulan la respuesta inmune humoral del bovino a través de la producción de anticuerpos protectores, lo que permite una respuesta inmune sostenida por un periodo de tiempo después de la aplicación de la vacuna, aun cuando el antígeno Bm86 natural del ectoparásito nunca entra en contacto con el huésped(48,49). Cuando el bovino es inoculado con una dosis inicial de la vacuna que contiene el antígeno Bm86, las células presentadoras de antígeno (APC), como las dendríticas y los macrófagos(50), capturan, procesan y presentan el antígeno en el ganglio linfático a través del antígeno leucocitario bovino (BoLA)(51). Las células dendríticas activadas interactúan con las células T vírgenes, que se diferencian en células T colaboradoras efectoras. Estas células migran a los centros germinales linfoides, donde interactúan con las células B vírgenes, lo que conduce a la formación de células B plasmáticas y de memoria. Las células plasmáticas migran a la médula ósea(52) e inducen la producción de anticuerpos específicos del antígeno, mientras que las células B de memoria se encuentran en el bazo y los ganglios linfáticos(53,54), en donde esperan la posterior inoculación (dosis de refuerzo) del antígeno (Figura 4).
Los anticuerpos anti-Bm86 presentes en la sangre del ganado inmunizado, llegan al intestino de la garrapata cuando estas se alimentan de animales vacunados. Los anticuerpos (IgM e IgG) se unen al antígeno Bm86 y activan el sistema del complemento (vía clásica), culminando en la lisis de enterocitos, trastocando su función de digerir y absorber los nutrientes de la sangre, afectando así la salud intestinal y general de la garrapata(55,56).
Estudios de inmunofluorescencia e inmunohistoquímica han mostrado que los anticuerpos reconocen la membrana plasmática del enterocito; sitio asociado con la proteína Bm86(57). En otros experimentos, la alimentación de garrapatas con suero de ganado inoculado con Bm86, demostró inhibición en la endocitosis, un efecto que precede al daño detectable de enterocitos(58).
Relacionado con lo anterior, en un estudio utilizaron el plásmido pBMC2 que codifica el antígeno Bm86 de la cepa de garrapata colombiana R. microplus, para realizar pruebas de inmunización en ratones y vacas. Los ratones inmunizados con pBMC2 mostraron altos niveles de anticuerpos anti-Bm86. Al evaluar los inmunógenos se observaron niveles significativos de IgG2a e IgG2b en ratones inmunizados con 50 mg de pBMC2. También evaluaron la persistencia de la respuesta de anticuerpos a la vacunación, ya que los niveles de anticuerpos séricos deben permanecer altos para que la vacuna sea efectiva. Las respuestas de anticuerpos estuvieron presentes 56 días después de la primera inmunización en ratones y de 70 días en bovinos. Además, el ganado inmunizado con 2 mg (1 ml) de pBMC2 tuvo un recuento medio de garrapatas inferior a 50, mientras que otros grupos (inmunizados con PBS o 1 mg de pBMC2) superaron este nivel(59). De manera similar, se ha empleado la forma recombinante antígeno Bm86 de la cepa Campo Grande (rBm86-CG) de R. microplus para estimular la inmunidad humoral del ganado. Los resultados de inmunotransferencia mostraron que el ganado vacunado desarrolló niveles significativos de anticuerpos contra rBm86-CG (P< 0.05), que alcanzaron su punto máximo 21 días después de la tercera vacunación(60).
Figura 4: Mecanismo de acción de la inmunidad inducida por el antígeno Bm86 en animales vacunados
1) La vacuna contiene la proteína recombinante Bm86. 2) Se inocula vía intramuscular (IM). 3) El receptor de linfocitos T (TCR) reconoce los epítopos de Bm86 unidos a moléculas de clase II del Complejo Mayor de Histocompatibilidad (MCH II) y se expresa en la superficie de las células presentadoras del antígeno (APC). 4) Los linfocitos T CD4+ (LT) colaboradores reconocen el complejo MCH II + péptido, y activados por las citoquinas dan comienzo a la respuesta inmune humoral. 5) El antígeno se adhiere a un receptor de los linfocitos B (LB), estimulando la proliferación y diferenciación a células plasmáticas, productoras de anticuerpos y células de memoria(51). Creado con BioRender.com
La proteína Bm86 como antígeno oculto
Los antígenos ocultos, son componentes de notable importancia fisiológica para los ectoparásitos, que habitualmente no participan en la interacción hospedero-parásito y que en su forma nativa no tienen contacto con el huésped durante la infestación natural, por lo que naturalmente no se desarrolla una respuesta inmune de ningún tipo contra ellos. No obstante, han demostrado ser capaces de desencadenar una respuesta inmune protectora cuando el huésped es expuesto a ellos en forma artificial, mediante inoculación de estos en una vacuna(61). El antígeno Bm86 se encuentra naturalmente en la pared intestinal de la garrapata R. microplus; esta proteína tiene una secuencia transmembranal que la mantiene unida a las células epiteliales del intestino de la garrapata, de modo que, en su forma natural, en ningún momento tiene contacto con el sistema inmune del huésped de la garrapata(55). Sin embargo, cuando esta proteína es empleada en su forma recombinante como antígeno vacunal provoca una respuesta inmune humoral en el animal; las inmunoglobulinas específicas contra Bm86 se unen al antígeno presentado en los enterocitos de la garrapata, ocasionando lisis de la pared intestinal de ésta, lo que interfiere en la digestión de la sangre y en la absorción de nutrientes, lo que a su vez reduce la producción de huevos (Figura 5). El empleo de estos antígenos en el diseño de vacunas, tiene la ventaja hipotética de evitar los mecanismos de evasión parasitaria, es decir, que gracias a la falta de contacto entre los antígenos ocultos y el sistema inmunológico, la garrapata no puede desarrollar una estrategia para escapar de la acción inmunitaria del animal(61). Sin embargo, dado que se ha demostrado un gran polimorfismo de este gen, esta supuesta ventaja de Bm86 como antígeno oculto es compensada por lo que es necesario considerar dicho polimorfismo en el desarrollo de vacunas a base de la proteína Bm86 recombinante. Adicionalmente, una de las desventajas de Bm86 como antígeno oculto es que induce una respuesta permanente. Por lo tanto, la inmunidad protectora inducida por derivados de Bm86 en vacunas es de corta duración(2,62), y requiere de dosis de refuerzo en intervalos de 6 meses(63).
Figura 5: Efecto de la respuesta inmune bovina sobre la garrapata
Los anticuerpos anti-Bm86 presentes en la sangre del bovino inmunizado, penetran por la boca de la garrapata hasta llegar al intestino. Los anticuerpos se unen al antígeno Bm86 y activan el sistema de complemento (vía clásica)(51). La activación del complemento comienza cuando dos o más fragmentos Fc (fragmento cristalizable) del anticuerpo reaccionan con el componente C1 (subcomponentes C1q, C1r y C1s)(64). El daño celular está mediado por el complejo de ataque a la membrana (MAC), que consiste en un polímero de componentes C5b, C6, C7, C8 y un polímero de C9. Los MAC causan daño lítico a las células, facilitando la separación de los lípidos de la membrana y creando poros a través de los cuales el agua, iones y macromoléculas pueden entrar y salir(64,65).
Análisis in silico de Bm86
La identificación de epítopos de células B en antígenos diana es un paso crucial para el desarrollo de vacunas basadas en estos, pruebas de inmunodiagnóstico, producción de anticuerpos y terapia de enfermedades(64). Las vacunas contra R. microplus que contienen el antígeno Bm86 se basan en subunidades o péptidos sintéticos, cuyo mecanismo se centra en los epítopos que son reconocidos por células B y T y el antígeno leucocitario bovino (BoLA) con lo que se predice una supuesta respuesta inmune específica(65). Dado que, los métodos experimentales para el mapeo de epítopos de células B requieren tiempo, son costosos y laboriosos; los métodos in-silico (diseño en computadora) para predecir epítopos de células B tanto lineales como conformacionales(64) son una herramienta versátil que permite a los investigadores manejar fácilmente variables en una secuencia de ADN, como: seleccionar secuencias promotoras; terminadoras; genes; regiones no traducidas; péptidos señal; insertar o eliminar sitios de restricción que faciliten manipulaciones en el laboratorio (66). Esta herramienta permite evaluar qué regiones de las proteínas de interés podrían ser candidatas para la creación de nuevas vacunas o tratamientos(67). Este fue el caso de tres péptidos (SBm4912, SBm7462 y SBm19733) generados por ensayos in-silico de la glicoproteína Bm86 del intestino de R. microplus, con los que inmunizaron ganado y evaluaron la respuesta inmunitaria mediante la detección de anticuerpos anti-Bm86. Los resultados revelaron una eficacia superior al 80% en el ganado inmunizado con el péptido sintético SBm7462. Así mismo, observaron una disminución en el número, peso y en la capacidad de oviposición de las hembras ingurgitadas en la población de garrapatas que se había alimentado de animales inmunizados(68). En un estudio emplearon el péptido sintético BD86 (un ortólogo Bm86 de Rhipicephalus decoloratus) para inmunizar ratones. Los resultados mostraron que los anticuerpos generados fueron capaces de reconocer ortólogos de Bm86 en cuatro especies: R. microplus, R. decoloratus, Hyalomma anatolicum anatolicum y R. appendiculatus, y se unieron al intestino de las garrapatas(69).
A nivel mundial, fueron identificados tres determinantes antigénicos de las secuencias de proteínas homólogas a Bm86. El análisis filogenético de los epítopos aislados y la proteína Bm86-CG (GenBank: ACA57829), reveló patrones geográficos entre los aislados de garrapatas R. microplus y los recolectados de la base de datos. Los autores proponen la posibilidad de lograr una vacunación eficaz contra las garrapatas del ganado utilizando un único antígeno universal basado en Bm86. Por lo tanto, a medida que las tecnologías genómicas continúen desarrollándose, será posible identificar nuevas vacunas candidatas contra diferentes especies de garrapatas en todo el mundo(70). Por otro lado, existen publicaciones que proponen una reducción de la eficacia de la vacuna basada en la proteína Bm86 debida al polimorfismo natural del gen en las poblaciones abiertas de garrapatas, lo que apunta a que deben utilizarse estrategias que abarquen una mayor variedad de antígenos derivados del polimorfismo de las poblaciones objetivo de garrapatas(71).
Alelos de Bm86 y genes ortólogos
El alto grado de polimorfismo de Bm86, ha llevado a la identificación de múltiples alelos de la proteína. En investigaciones recientes se han descubierto nuevas proteínas que comparten similitudes estructurales con Bm86, y que podrían ser buenas vacunas candidatas contra las garrapatas del ganado. Por ejemplo, un alelo del gen Bm86 identificado en Argentina y que ha sido utilizado como vacuna es el Bm95. Este alelo fue clonado y expresado en levaduras de P. pastoris, y la proteína recombinante demostró inducir protección en ganado frente a cepas resistentes y sensibles a la vacuna GAVAC®(72). Así mismo, los ensayos de inmunización controlados han demostrado que las vacunas que contienen Bm86 de Rhipicephalus microplus también protegen contra especies de garrapatas relacionadas, como; Rhipicephalus annulatus y Rhipicephalus decoloratus(73,74).
En tal sentido, algunos autores sugieren que la eficacia (Cuadro 3) de una vacuna basada en Bm86 puede mejorar cuando se emplea el antígeno Bm86 recombinante ortólogo (genes que comparten el último ancestro común y cuya divergencia se debe a la especiación)(75). Este es el caso de los ortólogos Bm86 de R. annulatus (Ba86) y de R. decoloratus (Bd86) que fueron empleados para inmunizar a los conejos. Los resultados evidenciaron reactividad inmunitaria cruzada de epítopos de las proteínas ortólogas de Bm86(48). Estos ensayos proporcionan un punto de partida para el desarrollo de formulaciones de vacunas mejoradas, incorporando varios antígenos protectores de garrapatas(11).
Así mismo, se ha usado el ortólogo de Bm86 de R. appendiculatus (Ra86) para vacunar ganado. Los resultados mostraron una disminución significativa en el éxito de muda de las ninfas, lo cual sugiere que las vacunas repetidas con Ra86 podrían reducir las poblaciones de garrapatas en generaciones sucesivas y podrían formar parte de las estrategias integrales de control para garrapatas(76).
Cuadro 3: Comparación de eficacia de alelos de Bm86 y sus ortólogos
Especie de garrapata (cepa) contra la que fueron probados los alelos y genes ortólogos de Bm86 | Alelos de Bm86 y genes ortólogos | Eficacia (%) | Referencias |
Rhiphicephalus haemaphysaloides | Bm95 | Larvas: 98.7 Ninfas: 84.6 Adultos: 78.9 | (75) |
Rhipicephalus microplus | Bm95 | 81.27 | (77) |
B. annulatus (cepa Mercedes, Texas, EE. UU.) | Ba86 | 83.0 | (78) |
B. microplus (cepa Susceptible, México) | Ba86 | 71.5 | (78) |
Rhipicephalus appendiculatus | Ra86 | Eclosión de huevos: 50 | (76) |
(%), Eficacia expresada en la reducción del número de garrapatas hembra adultas por cabeza de ganado, reducción de oviposición y de fertilidad.
Conclusiones
El control inmunológico es uno de los métodos más prometedores para el control de infestaciones por garrapatas en bovinos. Sin embargo, como se mencionó, las vacunas a base de la proteína Bm86, en ocasiones tienen un diferencial de efectividad (46.4-99.9 %) cuando la secuencia de la proteína vacunal es obtenida de garrapatas de una región determinada y empleada para combatir garrapatas de una región geográfica diferente. Este aspecto se atribuye a las diferencias en las secuencias que existen en la proteína Bm86 a lo largo del mundo (polimorfismo). Por lo anterior, se han realizado múltiples esfuerzos en la búsqueda de nuevas proteínas, antígenos basados en otros alelos del gen Bm86 o genes ortólogos que puedan estimular la respuesta inmune en el ganado y permitir el desarrollo de vacunas recombinantes más efectivas.
Tal es el caso de Colombia y México, quienes han diseñado vacunas a partir de cepas nacionales o locales de garrapatas, las cuales han mostrado resultados promisorios en el país de origen. De manera similar, en Argentina, se ha demostrado que la administración del alelo Bm95 como antígeno vacunal confiere protección superior al 80 %(79) contra cepas de garrapatas susceptibles o resistentes a ixodicidas. Se ha observado una mayor efectividad del antígeno cuando éste proviene de alelos de garrapatas locales, lo cual sugiere que el uso de antígenos nativos es importante para mejorar la eficacia de las vacunas contra la infestación por garrapatas. Finalmente, los ensayos de vacunas multiantígenas hasta la fecha han sido pocos y se han limitado a ensayos controlados debido a las dificultades en la formulación de antígenos. Por lo tanto, es importante que futuros estudios profundicen en estos temas para combatir de manera efectiva las infestaciones provocadas por garrapatas.
Financiamiento
Agradecemos al Consejo Nacional de Ciencia y Tecnología (CONACyT-México) por la beca otorgada para estudios de Doctorado al primer autor (DMGA) y por el financiamiento con Registro No. 156701 otorgado a JCVC por CONACyT.
Declaración de conflicto de interés
Los autores declaran no tener conflictos de intereses.
Literatura citada: