
https://doi.org/10.22319/rmcp.v14i2.6093
Artículo
Efecto de Xoconostle (Opuntia matudae Scheinvar) sobre la concentración de metano y las variables ruminales durante una fermentación in vitro de rastrojo de maíz
José Jesús Espino-García a
Isaac Almaraz-Buendía a
J. Jesús Germán Peralta-Ortiz a
Abigail Reyes-Munguía b
Iridiam Hernández-Soto a
Lucio González-Montiel c
Rafael Germán Campos-Montiel a*
a Universidad Autónoma del Estado de Hidalgo (UAEH). Instituto de Ciencias Agropecuarias. Avenida Universidad Km. 1 s/n Exhacienda Aquetzalpa, 43600. Tulancingo de Bravo, Hidalgo, México.
b Universidad Autónoma de San Luis Potosí (UASLP). Facultad de Estudios Profesionales Zona Huasteca. San Luis Potosí, México.
c Universidad de la Cañada (UNCA). Oaxaca, México.
*Autor de correspondencia: rcampos@uaeh.edu.mx
Resumen:
Se determinó el efecto de la adición de xoconostle en la fermentación ruminal in vitro de rastrojo de maíz con objeto de reducir la emisión de metano. Estudios previos han demostrado que el xoconostle contiene compuestos bioactivos con actividad antimicrobiana potencial que mejoran la fermentación ruminal. Se adicionaron el 0.0%, 2.0%, 4.0% y 6.0% de xoconostle. Se determinó la composición química de los sustratos, compuestos fenólicos, capacidad antioxidante, desaparición in vitro de la materia seca (DIVMS), la producción de ácidos grasos volátiles (AGV) y las variables de cinética de producción de gas. El volumen de metano se midió utilizando la técnica de captura de bióxido de carbono en solución de hidróxido de sodio. Con la adición del xoconostle se incrementó significativamente (P<0.05) el contenido de proteína, extracto etéreo, fenoles totales y actividad antioxidante. La DIVMS también se incrementó con la adición del xoconostle. Respecto a la producción de ácido propiónico, ésta se incrementó significativamente (P<0.05) con el 6.0 % de xoconostle. Los parámetros cinéticos obtenidos mediante el mejor ajuste de los datos experimentales mostraron una mayor tasa de digestión y menor producción de metano con la adición del 4.0 y 6.0 % de xoconostle. El uso de xoconostle como aditivo en dietas para rumiantes disminuye la producción de metano in vitro por lo que puede ser una alternativa para mitigar el incremento del efecto invernadero y beneficiar el cultivo de un fruto comercialmente no muy apreciado.
Palabras clave: Xoconostle, Rastrojo de maíz, Fermentación ruminal, Cambio climático, Metano entérico.
Recibido: 21/11/2021
Aceptado: 21/12/2022
Introducción
De acuerdo con la ONU, en investigaciones realizadas entre 2009-2019 por la Comisión Económica para América Latina y el Caribe (CEPAL), los países de América Latina son muy vulnerable a los efectos del cambio climático, por lo que urge adoptar medidas a corto plazo para disminuir su repercusión en los ecosistemas(1). El equilibrio natural de los gases efecto invernadero (GEI), que se encuentran en mayor proporción, bióxido de carbono (CO2) y metano (CH4), ha experimentado un desbalance en las últimas décadas debido a diversas actividades antropogénicas dando como resultado una acumulación en la atmósfera, el CO2 aumentó de 315 ppm en el año 1960 a 410 ppm en 2019(2); el CH4 de 1,770 ppb en 2000 a 1,860 ppb en 2019(3). La proporción de CH4 acumulado por año es menor que la de CO2, pero su potencial de calentamiento global es 25 veces superior(4). De las fuentes antropogénicas de CH4 el sector agropecuario es de los que más contribuye, la emisión de CH4 entérico como resultado del proceso digestivo de los rumiantes, es de aproximadamente 115 millones de toneladas anuales y corresponde al 20 % de las emisiones mundiales(5). De las estrategias utilizadas para mitigar las emisiones de CH4 entérico, la incorporación de aditivos en la alimentación animal al parecer es la más promisoria por su practicidad y economía.
Varios compuestos fenólicos contenidos en algunos vegetales tienen actividad antimicrobiana potencial, pudiendo mejorar la fermentación ruminal y disminuir la emisión de CH4(6). Dentro de los vegetales endémicos de México que tienen esta característica algunas especies del género Opuntia que producen frutos ácidos, conocidos como xoconostles, son una fuente importante de compuestos fenólicos, con actividad antimicrobiana potencial(7,8,9). A pesar del extenso número de investigaciones respecto a la reducción de GEI causados por metanogénesis en rumiantes, estudios utilizando cactáceas como forraje son pocos, y puede considerarse que no existe a la fecha estudios que relacionen la disminución de CH4 ruminal con metabolitos secundarios de xoconostle. Es importante que los productores pecuarios tengan acceso a tecnologías que les permita reducir las emisiones de CH4 de una manera que garantice la seguridad y bienestar animal, y que por otra parte sea económicamente viable. Por lo anterior, el objetivo de esta investigación fue evaluar el efecto del xoconostle en la fermentación in vitro de rastrojo de maíz (Zea mays).
Material y métodos
Área de estudio
El estudio se realizó en los laboratorios Multidisciplinario, Nutrición Animal y Análisis Especiales, del Instituto de Ciencias Agropecuarias de la Universidad Autónoma del Estado de Hidalgo (UAEH), en Tulancingo de Bravo, Hidalgo, México.
Obtención y preparación de las muestras
Frutos de xoconostle (Opuntia matudae Scheinvar cv. Rosa) en estado de madurez comercial cosechados en el estado de Hidalgo, México (Figura 1), se cortaron en rodajas y se deshidrataron durante 72 h en estufa con flujo de aire (Felisa 242 A, México) a 60°C. Posteriormente se molió (Pulverizador Weg, México) y pasó a través de una malla de 2 mm de diámetro. El rastrojo de maíz se obtuvo del Rancho Universitario de la Universidad Autónoma del Estado de Hidalgo y se deshidrató y pulverizó de la misma manera al xoconostle.
Figura 1: Frutos de xoconostle (Opuntia matudae Scheinvar cv. Rosa)
El líquido ruminal se obtuvo de dos ovinos (Hampshire, 54 kg peso vivo ± 2.4) vía cánula en rumen. Todos los procedimientos quirúrgicos se llevaron a cabo con base en el protocolo del Comité Institucional de Ética para el Cuidado y uso de Animales de Laboratorio de la UAEH y en apego a los lineamientos de la Ley de protección y trato digno para los animales del gobierno del estado de Hidalgo, México(10). Los ovinos recibieron antiparasitario comercial (Ivermectina, Bayer. 200 mcg/ kg peso vivo), vitaminas ADE (Vigantol ADE fuerte 2 ml) y se alimentaron ad libitum con rastrojo de maíz y premezcla mineral (Multi-Brick Triple, Malta-Cleyton) durante 15 días previos a la toma del líquido ruminal.
Caracterización fisicoquímica
La caracterización fisicoquímica de los sustratos (rastrojo de maíz y xoconostle) y de los tratamientos establecidos: 100 % maíz-0% xoconostle (0%Xoco); 98 % maíz-2% xoconostle (2%Xoco); 96 % maíz-4% xoconostle (4%Xoco) y 94 % maíz-6% xoconostle (6%Xoco) se llevó a cabo mediante análisis proximal, determinando: contenido de humedad; contenido de minerales (Mi); extracto etéreo (EE); proteína cruda (PC); fibra cruda (FC)(11). La proporción de fibra detergente neutro (FDN) y fibra detergente ácido (FDA) se determinó de acuerdo con lo descrito por Van Soest(12), las digestiones se llevaron a cabo utilizando bolsas filtro (Ankon F57 USA). En ambos casos se usó una bolsa sin sustrato como blanco para efectuar los cálculos.
Determinación de fenoles totales
El contenido de fenoles totales se determinó utilizando el método de Folin–Ciocalteu(13), la curva de calibración se construyó a partir de una solución estándar de ácido gálico (1 g/L H2O) y se obtuvieron diluciones 0-20 ppm. A 250 µl de cada dilución se agregaron 5 ml de Folin-Ciocalteu 1/10 en recipiente estanco a la luz y se dejó reposar por 8 min. Posteriormente se agregaron 4 ml de Na2CO3 7.5 % y se mantuvo 2 h en oscuridad. Se leyó la absorbancia a 765 nm (A765) (Spectronic-Genesys 5, USA) utilizando agua destilada como blanco. Aproximadamente 150 mg de muestra, rastrojo de maíz o xoconostle, se colocaron en viales de 2 ml adicionando 1.5 ml de metanol y 100 µl de NaF 2 mM con objeto de inhibir la polifenol-oxidasa (PPO). Se colocaron en recipiente estanco a la luz y se agitaron a temperatura ambiente durante 30 min. Se centrifugaron a 10,510 xg (Hermle Z36 HK, Alemania) por 20 min a 4 °C. Alícuotas de 250 µl de sobrenadante se trataron de la misma manera que las diluciones para construir la curva de calibración, se leyó absorbancia a 765 nm (A765) y se realizaron los cálculos correspondientes.
Determinación de la capacidad antioxidante
Método ABTS (2,2'-azino-bis (3-etilbenzotiazolina-6-ácido sulfónico))
El radical ABTS•+ se obtuvo después de la reacción de 10 ml de solución ABTS (7 mM) con 10 ml de solución de persulfato potásico (2.45 mM). La reacción se llevó a cabo a temperatura ambiente y en la oscuridad con agitación constante durante 16 h(14). Una vez formado el radical ABTS•+ se diluyó con etanol (20 %) hasta ajustar la absorbancia 0.7(±0.1) a 754 nm (A754) utilizando etanol (20 %) como blanco. Como antioxidante de referencia se utilizó diluciones de ácido ascórbico 0-100 ppm y ácido gálico 0-10 ppm para obtener las curvas de calibración. Aproximadamente 1 g de muestra se suspendió en 9 ml de etanol (50 %) en tubos de centrífuga estancos a la luz y se agitaron a temperatura ambiente durante 30 min. Se centrifugó a 10,510 xg a 4 °C por 20 min; 200 µl de sobrenadante, dilución de ácido ascórbico o gálico se adicionaron con 2 ml de ABTS•+ estandarizado, se dejó reposar 6 min y se determinó A754 utilizando etanol (20 %) como blanco. Las curvas de calibración se utilizaron para convertir las absorbancias obtenidas en las muestras, a equivalentes de ácido ascórbico (EAA) o equivalentes de ácido gálico (EAG) respectivamente.
Método DPPH (2,2-difenil-1-picrilhidrazilo)
Se usó el método desarrollado por Brand-Williams(15) con algunas modificaciones al descrito por Kim(16) donde la absorbancia del radical DPPH• 200 µM en metanol (80 %) agitado durante 2 h en recipiente estanco a la luz y ajustada su absorbancia a 515 nm (A515) a 0.7±0.1 con metanol (80 %) fue medida después de la reacción con un antioxidante de referencia. Como antioxidante de referencia se utilizó diluciones de ácido ascórbico 0-50 ppm y ácido gálico 0-5 ppm para obtener las curvas de calibración. Aproximadamente 1 g de muestra se suspendió en 9 ml de etanol (50 %) en tubos de centrífuga estancos a la luz y se agitaron a temperatura ambiente durante 30 min. Se centrifugó a 10,510 xg a 4 °C por 20 min; 0.5 ml de sobrenadante o de dilución de ácido ascórbico se adicionaron con 2.5 ml de DPPH• estandarizado, se dejó reposar 1 h y se determinó A515 utilizando metanol (80) como blanco.
pH y degradación in vitro de la materia seca (DIVMS)
El pH fue medido (HANNA, HI2211, Rumania) al terminar el tiempo de incubación y el contenido de cada frasco fue transferido a tubos de polisulfona de 50 ml, los cuales se centrifugaron (HERMLE, Z326K, Alemania) a 15,130 xg durante 15 min. El sobrenadante se retiró por decantación y el material sólido se secó a 65 °C por 48 h. La DIVMS se calculó como la diferencia entre el peso de la materia seca inicial y el peso de la materia seca residual y se expresó como g/100 g MS.
Determinación de ácidos grasos volátiles (AGV)
Al final de la fermentación, 1.6 ml de la fracción líquida de los frascos de fermentación se colocaron en viales de 2.5 ml que contenían 0.4 ml de HPO3 25% p/v, se almacenaron a 5°C. Posteriormente se centrifugaron a 15,130 xg 15 min. La concentración, milimoles/litro (mM L-1) de AGV se determinó en un cromatógrafo de gases Claurus 500, Perkin Elmer, USA, provisto con automuestreador, columna capilar (ELITE-FFAP, Perkin Elmer, USA) de 15 m, y detector de ionización de flama (FID). El gas acarreador fue N2 a 60 psi, se usó H2 y aire extra seco para generar la flama. Las temperaturas del horno, inyector y columna fueron 120, 250 y 250 °C, respectivamente. El tiempo de retención fue de 1.22, 1.55 y 2.02 min para acético, propiónico y butírico, respectivamente. Previamente fue construida una curva de calibración con soluciones estándar de ácido acético, propiónico y butírico(17).
Fermentación y producción de gas
En frascos de vidrio con capacidad de 125 ml se depositaron 0.5 g de sustrato correspondiente a cada tratamiento rastrojo de maíz-xoconostle. El líquido ruminal se filtró a través de ocho capas de gasa y se almacenó a 39 °C en condiciones anaerobias hasta su uso. A cada frasco y bajo flujo continuo de CO2, se agregaron 40 ml de medio de cultivo y 4 ml de líquido ruminal. Por litro de solución el medio de cultivo contiene: 1 g NH4HCO3; 8.74 g NaHCO3; 1.43 g Na2HPO4; 1.55 g KH2PO4; 0.15 g MgSO4.7H2O; 0.017 g CaCl2.2H2O; 0.013 g MnCl.4H2O; 0.0013 g CoCl.6H2O; 0.01 g FeCl3; 1.29 ml de solución rezasurina 0.1 % como indicador y 37 ml de solución reductora conteniendo 0.21 g Na2SO4 y 1.5 ml de solución 0.1N NaOH. Los frascos se cerraron herméticamente (Engargoladora manual, Wheaton, USA) mediante un tapón siliconado y una cápsula vial con centro desprendible. Recipientes similares con solamente inóculo ruminal se incluyeron como blancos. Los frascos se incubaron en baño maría a 39 °C. El volumen de gas producido (ml) dentro de cada frasco a 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16, 18, 22, 26, 30, 42, 54, 66, 78, 92 h de incubación, se registró mediante el desplazamiento de volumen de agua realizando una punción a través del tapón de silicón usando una aguja hipodérmica acoplada a una columna de vidrio graduada conteniendo agua. Después de cada medición se liberó el gas igualando la presión interna y externa de los frascos(18).
La velocidad a que tiene lugar la producción de gas depende de las características de la microbiota ruminal presente(19); así como del tipo de sustrato, pH, potencial Redox(20) dando como resultado diferentes perfiles cinéticos. La descripción matemática de estos perfiles permite comparar características de los sustratos o del ambiente de fermentación. El ajuste de los datos experimentales al modelo Logístico mediante el software Sigma Plot 12© permitió obtener la Ecuación 1; donde y (ml g-1 MS) denota la cantidad de gas acumulado producido por gramo de materia seca (MS) al tiempo t (h) durante la incubación. A (ml g-1MS) representa la máxima producción de gas a tiempo infinito. to (h) es el tiempo de incubación en el que se ha producido la mitad de A y b es una constante adimensional que determina el perfil característico y por lo tanto el punto de inflexión de la curva(21).
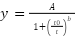 Ec. (1)
Ec. (1)
El punto de inflexión indicador de la fase de retardo (L) o Ecuación 2 resultante de dy/dt es:
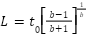 Ec. (2)
Ec. (2)
Considerando la desaparición de sustrato (P) como una cinética de primer orden, la tasa de digestión del sustrato (S) (Ecuación 3) para valores de b>1 aumenta hasta alcanzar un máximo (Smax) cuando el tamaño de la población microbiana ya no limita la fermentación del alimento. El tiempo en el que se alcanza Smax está dado por la resolución de dS/dt=0 (Ecuación 4)(21).
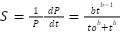 Ec. (3)
Ec. (3) 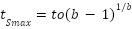 Ec. (4)
Ec. (4)
Determinación de metano
El volumen de CH4 se midió mediante la técnica descrita por Torres-Salado(22) con las siguientes modificaciones: el frasco biodigestor se acopló mediante una manguera Taygon® (2.38 mm Ø interno y 30 cm de longitud) con agujas hipodérmicas (20 G x 32 mm) en los extremos a un vial invertido y totalmente lleno con NaOH 2 N. El gas originado por la fermentación del sustrato fluye a través del NaOH 2N, donde el CO2 reacciona y forma carbonato de sodio. El gas residual es insoluble en la solución y corresponde a CH4, donde la cantidad se cuantifica según los ml de NAOH 2N desplazados a través de otra aguja hipodérmica colocada en el tapón siliconado como válvula de salida y medidos con una probeta.
Análisis estadístico
Se utilizó un diseño completamente al azar, el modelo estadístico utilizado fue:
Yij = µ + t i + εij
Donde:
Yij Variable respuesta de la ij-esima unidad experimental;
µ Efecto de la media general;
t i Efecto del i-esimo tratamiento;
εij Efecto del error experimental asociado a la i-esima unidad experimental.
Cada tratamiento tuvo cinco repeticiones independientes siendo la unidad experimental un frasco con 500 mg de sustrato. El análisis de datos se hizo mediante ANOVA y la comparación de medias con la prueba de Tukey ajustada a un nivel de significancia α=0.05.
Resultados y discusión
Caracterización fisicoquímica y capacidad antioxidante de los sustratos utilizados
La concentración de humedad, PC, EE y cenizas en el Xoconostle (Cuadro 1) es similar a lo reportado por Sánchez-González(23), donde la variación en estos nutrientes depende de la madurez y de las condiciones de cultivo. Información acerca de la proporción de FDN, FDA es de escasa a nula debido a que este fruto se utiliza principalmente en la alimentación humana, donde la relevancia se debe a sus propiedades benéficas y antioxidantes como lo reportaron Morales y Espinoza-Muñoz(24,25). No obstante, al ser un fruto del nopal, la concentración de FDN es similar a la tuna (52 % vs 40.74 %) con base en lo reportado en el NRC(26). El contenido de compuestos fenólicos y actividad antioxidante en el rastrojo de maíz utilizado en este estudio (Cuadro 1) es próximo a lo reportado por Vázquez-Olivo(27) para rastrojo de maíz con valores de 219 EAG/100 g muestra. Respecto al xoconostle, el contenido de fenoles totales es consistente con lo reportado por otras investigaciones(28,29).
Cuadro 1: Caracterización fisicoquímica y capacidad antioxidante de los sustratos utilizados
Rastrojo de maíz (%BS) | Xoconostle (%BS) | ||
Materia seca | 92.97 ± 0.003 | 87.27 ± 0.002 | |
Minerales | 7.45 ± 0.001 | 13.13 ± 0.002 | |
Proteína cruda | 3.46 ± 0.004 | 4.82 ± 0.004 | |
Extracto etéreo | 0.78 ± 0.020 | 4.07 ± 0.008 | |
Extracto libre nitrógeno | 88.31 ± 0.002 | 77.98 ± 0.001 | |
Fibra detergente neutro | 68.05 ± 0.008 | 40.74 ± 0.024 | |
Fibra detergente ácido | 36.99 ± 0.016 | 30.34 ± 0.067 | |
Fenoles totales | 246.93 ± 0.206 mg EAG 100 g-1 | 740.59 ± 0.461 mg EAG 100 g-1 | |
Actividad antioxidante | DPPH | 4.94 ± 0.013 mg EAG 100 g-1 | 21.42 ± 0.028 mg EAG 100 g-1 |
22.77 ± 0.037 mg EAA 100 g-1 | 66.80 ± 0.076 mg EAA 100 g-1 | ||
ABTS | 10.87 ± 0.050 mg EAG 100 g-1 | 19.73 ± 0.260 mg EAG 100 g-1 | |
99.74 ± 0.048 mg EAA 100 g-1 | 191.43 ± 0.273 mg EAA 100 g-1 | ||
Valores promedio ±DS de tres repeticiones. EAG (equivalentes ácido gálico) EAA (equivalentes ácido ascórbico).
La caracterización fisicoquímica de los tratamientos se muestra en el Cuadro 2, donde se observa que el contenido de MS disminuye al aumentar el contenido de xoconostle, esto se debe a que la humedad contenida en el fruto es mayor a la del rastrojo de maíz, por el contrario, la concentración de Mi y PC aumenta proporcionalmente en los tratamientos dado que al sustituir rastrojo por xoconostle, este último contiene mayor porcentaje de estos componentes como se muestra en el Cuadro 1. Respecto al EE al aumentar la cantidad sustituida de rastrojo por xoconostle, la proporción de esta fracción en los tratamientos aumenta de manera sustancial, pues la magnitud del extracto determinado en el xoconostle es 4.21 veces mayor que en la del rastrojo de maíz. Algunas variedades de xoconostle como Opuntia matudae Scheinvar cv. Rosa contiene ácidos grasos saturados como el palmítico y mirístico; y poliinsaturados como oléico y linoléico(24). No obstante el incremento de EE (Cuadro 2), la concentración de lípidos en los tratamientos de este estudio se considera no influye en la metanogénesis ya que su efecto se ha observado a partir de 50 g kg-1 de materia seca en la dieta(30). El ELN incluye los carbohidratos asimilables y la fibra cruda, este parámetro disminuye al aumentar la cantidad sustituida de rastrojo de maíz por xoconostle ya que éste último a pesar de contener mayor cantidad de carbohidratos simples que el rastrojo de maíz, tiene una menor proporción de carbohidratos estructurales, 18 % menos de FDA. Esta disminución en la FDA da como resultado una mejor digestibilidad del alimento, ya que el suministro de carbohidratos no estructurales, hasta cierto límite, reduce la fase de retardo y mejora el contenido energético de la dieta siendo determinante en la producción de proteína bacteriana ruminal. El aumento en el porcentaje de xoconostle como sustituto incrementó también el contenido de FT y la actividad antioxidante. La presencia de compuestos fenólicos pudiese tener un efecto sobre algunos microorganismos del rumen; se ha demostrado que estos metabolitos secundarios de las plantas tienen un efecto inhibitorio, Diaz-Solares y otros, evaluaron el contenido de fenoles y flavonoides asi como la capacidad antimicrobiana de extractos de hojas de Morus alba encontrando presencia abundante con actividad frente a S. aureus, E. coli, P. aeruginosa, K. pneumoniae y S. β hemolitico sugiriendo su uso en alimentación animal(31). Hayek e Ibrahim(7), reportan efecto inhibitorio de extractos acuosos de xoconostle sobre E.coli. Se ha demostrado que los compuestos fenólicos contenidos en algunos vegetales mejoran la fermentación ruminal y disminuyen la producción de metano(32,33,34).
Cuadro 2: Caracterización fisicoquímica de los tratamientos
0% Xoco | 2% Xoco | 4% Xoco | 6% Xoco | |||
(%BS) | ||||||
Materia seca | 92.97 ± 0.003a | 92.85 ± 0.000b | 92.74 ± 0.005c | 92.62 ± 0.003d | ||
Minerales | 7.45 ± 0.001ª | 7.57 ± 0.000b | 7.68 ± 0.005c | 7.80 ± 0.003d | ||
Proteína cruda | 3.46 ± 0.004ª | 3.49 ± 0.000b | 3.52 ± 0.001c | 3.54 ± 0.000d | ||
Extracto etéreo | 0.78 ± 0.020ª | 0.85 ± 0.000b | 0.91 ± 0.003c | 0.98 ± 0.002d | ||
Extracto libre nitrógeno | 88.31 ± 0.002ª | 88.09 ± 0.001b | 87.89 ± 0.010c | 87.67 ± 0.006d | ||
Fibra detergente neutro | 68.05 ± 0.008ª | 67.48 ± 0.003b | 66.94 ± 0.028c | 66.37 ± 0.016d | ||
Fibra detergente ácido | 36.99 ± 0.016ª | 36.85 ± 0.000b | 36.72 ± 0.006c | 36.58 ± 0.004d | ||
Fenoles totales, mg EAG 100 g-1 | 246.93±0.206ª | 257.30±0.051b | 266.97±0.505c | 277.34±0.287d | ||
Actividad antioxidante | DPPH | EAG | 4.94 ± 0.013ª | 5.29 ± 0.002b | 5.61 ± 0.017c | 5.96 ± 0.010d |
EAA | 22.77 ± 0.037ª | 23.73 ± 0.005b | 24.56 ± 0.045c | 25.48 ± 0.026d | ||
ABTS | EAG | 10.87 ± 0.05ª | 11.06 ± 0.001b | 11.23 ± 0.009c | 11.42 ± 0.005d | |
EAA | 99.74 ± 0.048ª | 101.67±0.010b | 103.460.094c | 105.39 0.053d | ||
Valores promedio ± DE de cinco repeticiones. EAG (equivalentes de ácido gálico); EAA (equivalentes de ácido ascórbico).
abcd Valores en la misma línea con diferente superíndice son diferentes (P<0.05).
pH y DIVMS
Los valores de pH del líquido ruminal de los tratamientos al final de la fermentación no mostraron diferencia significativa (P>0.5) (Cuadro 3). La utilización de una solución tampón a base de bicarbonato y fosfatos en el medio de cultivo probablemente mantuvo el pH con valores por encima de 6.0 durante el tiempo de fermentación favoreciendo la digestibilidad de la MS. Valores de pH por debajo de 6.0 inhiben el desarrollo de las bacterias celulólíticas (i.e. dietas con alto contenido de concentrados) y dan lugar a mayores tiempos en la fase de retardo (L) y a una disminución en la DIVMS(35,36). Uno de los parámetros de calidad de los forrajes es la DIVMS, ya que indica la eficiencia con que pueden ser metabolizados por los rumiantes. En este estudio, el tratamiento 6% Xoco tuvo una mayor DIVMS que el control (P<0.05). El tratamiento 4% Xoco no presentó diferencia estádistica respecto al testigo pero si una tendencia a incrementar, entre ambos tratamientos no hubo diferencia significativa (P>0.05), este incremento en la DIVMS debido posiblemente a la adición de carbohidratos no estructurales del xoconostle ocasionó una mejor fermentación dando como resultado una menor fase de retardo y una mayor tasa de digestión (Cuadro 3). La digestibilidad in vitro de la FDN (DIVFDN) no mostró diferencia entre los tratamientos (P>0.05) lo que podría indicar que los compuestos bioactivos del xoconostle no tienen actividad sobre las bacterias celulolíticas y que la degradación de los carbohidratos estructurales no se ve afectada. Respecto al nitrógeno total no se tuvo diferencia significativa entre los tratamientos (P>0.05) pero, la concentración al final del experimento se incrementó probablemente como resultado de la acción bacteriana sobre las proteínas solubilizando el nitrógeno.
Cuadro 3: Variables de respuesta después de 92 h de fermentación
0% Xoco | 2% Xoco | 4% Xoco | 6% Xoco | ||
pH | 6.43 ± 0.059 | 6.43 ± 0.019 | 6.44 ± 0.019 | 6.43 ± 0.019 | |
DIVMS, % | 73.97 ± 4.73ªb | 72.76 ± 3.07a | 78.99 ± 4.70bc | 80.44 ± 4.71c | |
DIVFDN, % | 89.31 ± 1.94 | 88.67 ± 1.27 | 88.61 ± 2.55 | 89.69 ± 2.48 | |
Nitrógeno | Inicial | 0.0338 ± 0.003 | 0.0338±0.002 | 0.0338±0.001 | 0.0339±0.002 |
Total, mg dl-1 | Final | 0.036 ± 0.002 | 0.04 ± 0.003 | 0.04 ± 0.003 | 0.04 ± 0.002 |
Valores promedio ±DE de cinco repeticiones.
abc Valores en la misma línea con diferente superíndice son significativamente diferentes (P<0.05).
Producción de ácidos grasos volátiles (AGV)
La concentración de AGV (mM L-1) en el líquido ruminal como resultado de la fermentación se muestran en el Cuadro 4 donde se observa que el tratamiento 6% Xoco tiene diferencia en la cantidad de ácido propiónico generado (P<0.05) que sugiere que el xoconostle tiene un efecto en la microbiota ruminal direccionando la fermentación ruminal hacia una disminución de H+ disponible, necesario para la producción de CH4(33), otra posibilidad es que el metabolismo de compuestos fenólicos contenidos en el xoconostle incremente la síntesis de ácido propiónico lo que también disminuye la producción de metano pero sin tener un efecto directo sobre los micoorganismos ruminales (Ku Vera, et al)(37).
Cuadro 4: Concentración y proporción de AGV originados por la fermentación in vitro de rastrojo de maiz y xoconostle
0% Xoco | 2% Xoco | 4% Xoco | 6% Xoco | |
Acético, mM L-1 | 35.6 ± 2.43 | 35.8 ± 0.862 | 33.1 ± 0.100 | 33.8 ± 02.34 |
Propiónico, mM L-1 | 14.8 ± 0.898a | 14.5 ± 0.412a | 13.8 ± 0.350a | 16.85 ± 0.845b |
Butírico, mM L-1 | 5.2 ± 0.340 | 5.1 ± 0.186 | 4.9 ±0.165 | 5.4 ± 0.793 |
Total, mM L-1 | 55.6 | 55.4 | 51.8 | 56.05 |
Acético, % | 64.0 | 64.6 | 63.9 | 60.3 |
Propiónico, % | 26.6 | 26.2 | 26.6 | 30.1 |
Butírico, % | 9.4 | 9.2 | 9.5 | 9.6 |
Acético/Propiónico | 2.40 | 2.46 | 2.40 | 2.00 |
Valores promedio ±DE de tres repeticiones.
ab Valores en la misma línea con diferente superíndice son significativamente diferentes (P<0.05).
Producción de gas
Los perfiles de producción de gas total acumulado y de gas metano (Figura 2a y 2b) muestran que los tratamientos tienen un comportamiento sigmoidal durante las 92 h de incubación siguiendo el comportamiento logístico(38), el modelo matemático utilizado(21) permitió efectuar un buen ajuste de los datos (R2 >0.99). Respecto al volumen acumulado de gas total, el tratamiento 2% Xoco fue diferente (P<0.05) observándose una mayor producción de gas respecto de los tratamientos 4 y 6% Xoco (Cuadro 5), probablemente al aumentar la cantidad de compuestos fenólicos contenidos en el xoconostle se tiene una consecuencia en la actividad de la microbiota ruminal, resultados similares fueron determinados en estudios previos(39). La incorporación de compuestos fenólicos como los taninos en una fermentación ruminal tienen efecto sobre la microbiota ya que pueden unirse a la pared celular de los microorganismos causando cambios morfológicos o secreción de enzimas extracelulares o pueden unirse a enzimas provocando cambios en su metabolismo(40). Los perfiles de producción de CH4 (Figura 2b) muestran que el volumen producido tiende a disminuir en respuesta a la incorporación de xoconostle, siendo el tratamiento 6% Xoco donde el efecto es más evidente. Existen diversos estudios que abordan la reducción de metano entérico a partir de la incorporación de compuestos fenólicos, como por ejemplo el de Tiemann(41), que evaluó el efecto de dos leguminosas ricas en taninos condensados sobre las emisiones de metano en corderos logrando una reducción de hasta 24 % pero reduciendo la digestibilidad de la materia seca. En este estudio, se logró una reducción del 8.5 % en el tratamiento 6% Xoco sin tener este efecto negativo.
Figura 2: Volumen de gas total (a) y metano (b) durante 92 h de fermentación in vitro
Los parámetros cinéticos resultantes del ajuste al modelo Logístico se muestran en el Cuadro 3 y mediante la Ecuación 4, determinan tsmax para los tratamientos del estudio siendo de 5.3, 2.8, 0.9 y 1.1 h para 0% Xoco, 2% Xoco, 4% Xoco y 6% Xoco respectivamente (Figura 3). Una reducción en el tiempo para alcanzar la tasa máxima de digestión del sustrato representa una mejor digestibilidad y por lo tanto menor producción de metano.
Cuadro 5: Parámetros cinéticos obtenidos del ajuste al modelo Logístico
0% Xoco | 2% Xoco | 4% Xoco | 6% Xoco | |
Agas total, ml g MS-1 | 334.88a | 395.48b | 356.84a | 351.26a |
ACH4, ml g MS-1 | 193.60a | 188.70a | 177.2a | 184.3a |
b (-) | 1.1978a | 1.0031b | 0.9474b | 0.9325b |
To, h | 21.142a | 33.902b | 20.598a | 19.97a |
Smax, h-1 | 0.026a | 0.037b | 0.049c | 0.052d |
tSmax, h | 5.32a | 2.84b | 0.90c | 1.10bc |
L, h | 2.76a | 1.41b | 0.44b | 0.54b |
R2 | 0.9938 | 0.9942 | 0.9945 | 0.9947 |
Agas total (gas total CO2 + CH4); ACH4 (metano producido); S (tasa de digestión); tSmax (tiempo para alcanzar Smax); L (fase de retardo).
abcd Valores en la misma línea con diferente superíndice son significativamente diferentes (P<0.05).
Figura 3: Cambio en la tasa de digestión (S) durante las 92 h de fermentación
Conclusiones e implicaciones
La adición de xoconostle en una fermentación in vitro de rastrojo de maíz aumentó la tasa de digestión y redujo la fase de retardo lo que se traduce en una mejora de la digestibilidad del sustrato. Los compuestos bioactivos del xoconostle incrementan en un 13.1 % la producción de ácido propiónico cuando se adiciona el 6% de xoconostle y reducen en un 8.5 % la producción de metano con la adición de 4% de xoconostle.
Literatura citada: