https://doi.org/10.22319/rmcp.v13i3.5878
Revisión bibliográfica
Efectos de los fitoestrógenos en la fisiología reproductiva de especies productivas. Revisión
Miguel Morales Ramírez a
Dinorah Vargas Estradab
Iván Juárez Rodríguez c
Juan José Pérez-Rivero d
Alonso Sierra Reséndiz b
Héctor Fabián Flores González e
José Luis Cerbón Gutiérrez f
Sheila Irais Peña-Corona*g
a Universidad Autónoma Metropolitana. Unidad Iztapalapa, Departamento de Biología de la Reproducción, Ciudad de México, México.
b Universidad Nacional Autónoma de México (UNAM). Facultad de Medicina Veterinaria y Zootecnia, Departamento de Fisiología y Farmacología, Ciudad de México, México.
c UNAM. Facultad de Medicina Veterinaria y Zootecnia, Departamento de Medicina Preventiva y Salud Pública, Ciudad de México, México.
d Universidad Autónoma Metropolitana. Unidad Xochimilco, Departamento de Producción Agrícola y Animal, Ciudad de México, México.
e UNAM. Facultad de Medicina Veterinaria y Zootecnia, Departamento de Genética y Bioestadística, Ciudad de México, México.
f UNAM. Facultad de Medicina Veterinaria y Zootecnia, Departamento de Reproducción, Ciudad de México, México.
g UNAM. Facultad de Química, Departamento de Biología, Ciudad de México, México.
*Autor de correspondencia: sheila.ipc@live.com
Resumen:
Los fitoestrógenos (FEs) son compuestos químicos provenientes del metabolismo secundario de algunos vegetales, tienen un efecto potencial sobre los parámetros reproductivos de los animales domésticos, al actuar como agonistas o antagonistas de los receptores estrogénicos. El objetivo de esta revisión es conocer los efectos que produce una dieta rica en FEs en la fisiología reproductiva de los animales de abasto. Se realizó una revisión sistemática en dos bases de datos mediante el uso de palabras clave relacionadas con los efectos que produce la ingestión de FEs en la dieta, sobre la reproducción de animales de abasto, únicamente se consideraron los estudios controlados desarrollados in vivo. Se encontraron resultados contradictorios, por un lado, la ingesta de un alto contenido de los compuestos polifenólicos, provenientes de distintos forrajes en la hembra bovina, estuvo relacionado con la disminución de la fertilidad, presencia de abortos y de quistes ováricos; por otro lado, la ingesta de alto contenido de FEs indujo un aumento en la calidad seminal de los machos de las especies: bovinos, ovinos y lepóridos; por lo que, dichos efectos se pueden atribuir a la concentración, al tipo de FEs, sexo, especie e incluso a la raza del animal.
Palabras clave: Fitoestrógenos, Animales de abasto, Efectos reproductivos, Coumestanos, Isoflavonas, Lignanos.
Recibido: 25/11/2020
Aceptado: 04/08/2021
Introducción
En las actividades pecuarias, la elección de la alimentación representa uno de los principales costos de producción y es uno de los aspectos técnicamente más complejos para la búsqueda de la satisfacción nutricional en las diferentes etapas de producción animal (cría, recría, gestación, lactancia, destete, crecimiento y engorda), considerando su estado fisiológico, edad y raza(1-4).
Generalmente, la alimentación de los animales de abasto (AA) está basada en granos de sorgo y maíz, ya que, proporcionan una fuente rica en energía, además de otros alimentos que aportan proteína, como la soya, la canola, alfalfa y trébol(2-4). Es de importancia resaltar que se ha sugerido que se realicen cambios en la fuente de alimento o forraje en el caso de que se presenten alteraciones en la reproducción de los AA(4).
Los alimentos de origen vegetal, se consideran una fuente rica en fitoestrógenos (FEs), compuestos polifenólicos no esteroides derivados del metabolismo de las plantas con estructura conformacional parecida al 17-β estradiol (E2)(3,5). Cuando son ingeridos por los animales, los FEs pueden actuar como moduladores selectivos de los receptores estrogénicos (REs) y ejercer como disruptores endocrinos de manera agonista o antagonista, dependiendo de la dosis ingerida(5,6), interfiriendo así en la síntesis, secreción, transporte y metabolismo de las hormonas reproductivas, durante el desarrollo embrionario y en la vida adulta(6-11).
Se han reconocido cerca de 100 FEs; estos son categorizados de acuerdo a su estructura química, en cuatro clases: isoflavonoides (genisteína, daidzeína, formononetina); flavonoides (naringenina, kaemferol); coumestanos (coumestrol “COU”, sativol, diacetato de COU, 4-metoxicoumestrol), y lignanos (enterolactona y enterodiol)(12,13). La soya, es la fuente más abundante de isoflavonas, pues es uno de los alimentos con mayor contenido de genisteína y daidzeína, mientras que la alfalfa y el trébol contienen alta cantidad de coumarinas. Cabe mencionar que los FEs se encuentran presentes de manera natural en las plantas, como glucósidos, los cuales se hidrolizan a aglicona (forma activa) catalizada por enzimas presentes en el sistema digestivo(14,15).
A través de varios estudios, se ha demostrado que la ingestión de FEs provoca alteraciones reproductivas en los animales de ambos sexos, así como síndromes temporales de infertilidad(16,17). Sin embargo, también hay evidencia que los FEs favorecen la reproducción por incrementar la concentración, motilidad y volumen espermático necesarias para la fertilización(18-20).
Debido a la importancia económica y productiva que representan las alteraciones reproductivas en el contexto de la producción animal, el objetivo de este trabajo es conocer el efecto potencial que tienen los alimentos ricos en FEs sobre la reproducción de los AA.
Método
El presente documento se desarrolló de acuerdo con la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)(21).
Búsqueda de la literatura
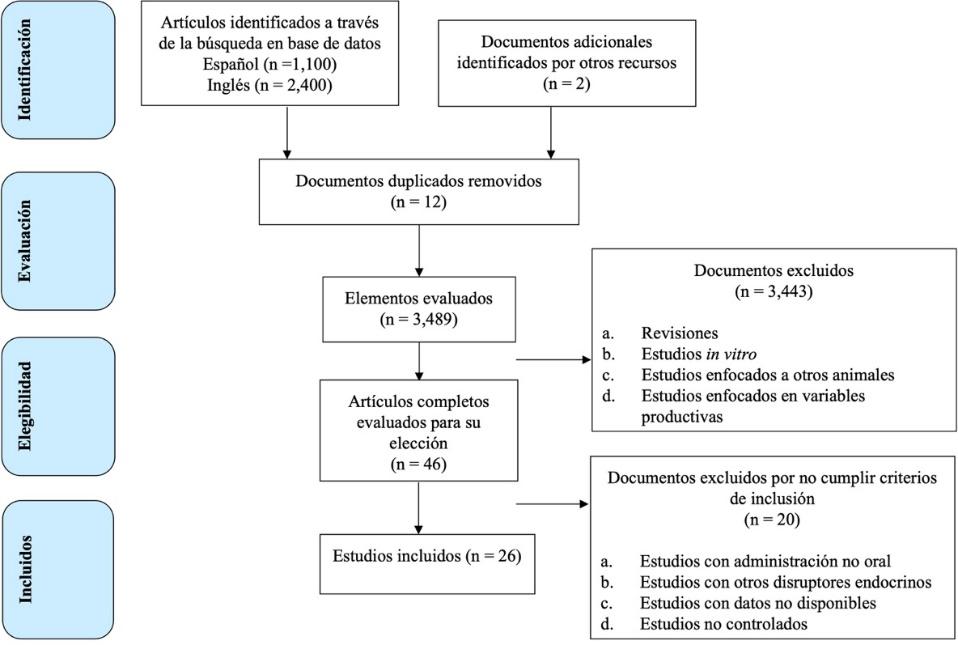
Se realizó una revisión sistemática en la Web (Figura 1); se utilizaron como buscadores de información especializada, los recursos Google Scholar y PubMed con el objetivo de identificar los estudios que exploraran los efectos de los FEs presentes en la dieta sobre la fisiología reproductiva de los AA, que se hayan publicado en revistas con arbitraje ciego por pares, resúmenes en extenso en congresos de especialidad, y en tesis de grado entre 1996 y 2019. Las palabras clave, se establecieron de acuerdo al principio PICO (Participantes, Intervenciones, Comparaciones y Resultados [Outcomes]): P como animales de abasto (bovinos, ovinos, caprinos, equinos, porcinos, lepóridos y aves); I como alimentación con dieta rica en FEs; C como grupos control, o grupos de animales con alimentación baja en fitoestrógenos, o variables reproductivas del mismo grupo experimental reportado antes o después de la exposición a la dieta alta en fitoestrógenos; y R como variables reproductivas en machos y en hembras. La declaración del tema de la pregunta de la revisión se desarrolló como: ¿Los fitoestrógenos presentes en la dieta producen efectos adversos en variables reproductivas de los AA? De acuerdo con las palabras clave, se buscó primero en el recurso Google Scholar y, posteriormente, en PubMed, con fecha hasta junio del 2020. Generalmente, se utilizaron las siguientes palabras y buscadores boleanos, a fin de identificar los estudios disponibles en la red: {‘Reproduction’ AND ‘Animals’ AND ‘Phytoestrogens’ AND/OR ‘Fertility’ AND/OR ‘Feed’ AND/OR ‘Isoflavones’ AND/OR ‘Coumestans’, AND/OR ‘Lignans’ AND ‘Cows’ OR ‘Heifers’ OR ‘Bulls’ OR ‘Ewes’ OR ‘Small Rumninant’ OR ‘Sheep’ OR ‘Ovine’ OR ‘Goat’ OR ‘Nanny-goat’ OR ‘Equine’ OR ‘Mare’ OR ‘Horses’ OR ‘Porcine’ OR ‘Sows’ OR ‘Pigs’ OR ‘Leporids’ OR ‘Rabbits’ OR ‘Hens’ OR ‘Rooster’ OR ‘Chickens’} {‘Reproducción’ AND ‘Animales’ AND ‘Fitoestrógenos’ AND/OR ‘Fertilidad’ AND/OR ‘Alimentación’ AND/OR ‘Isoflavonas’ AND/OR ‘Coumestanos’ AND/OR ‘Lignanos’ AND ‘Vacas’ OR ‘Vaquillas’ OR ‘Toros’ OR ‘Pequeños rumiantes’ OR ‘Ovejas’ OR ‘Ovinos’ OR ‘Cabras’ OR ‘Equinos’ OR ‘Yeguas’ OR ‘Caballos’ OR ‘Porcinos’ OR ‘Cerdas’ OR ‘Lepóridos’ OR ‘Conejos’ OR ‘Aves’ OR ‘Gallinas’ OR ‘Gallos’ OR ‘Pollos’}. Todos los artículos se buscaron en inglés y en español, se examinaron inicialmente mediante la lectura de sus resúmenes. Los textos completos de los documentos incluidos de forma preliminar se volvieron a revisar para seleccionar el material a utilizar. En la figura 1 se muestra un diagrama de flujo que detalla la selección de estudios.
Figura 1: Diagrama de flujo del progreso de la búsqueda del estudio
Criterios de inclusión y exclusión
Se consideraron trabajos sobre experimentos controlados in vivo, en AA alimentados con una dieta rica o suplementada con FEs (soya, trébol, alfalfa) por más de siete días, y que incluyeran la determinación de la cantidad de FEs ingeridos o información suficiente para calcularla, en ese caso, la cantidad de FEs en la dieta (mg/kg de MS [materia seca]) se obtuvo de la base de datos del Departamento de Agricultura de los Estados Unidos [United States Department of Agriculture; USDA(22,23)], asimismo para obtener la cantidad de alimentación diaria se obtuvo la relación del peso del animal y la cantidad de alimento consumido que contenía los FEs (reportado en el artículo). Se excluyeron aquellos estudios en los que la administración del FE no se relacionó con la alimentación, o se administraba vía oral a través de un excipiente, o cuando no se evaluaron parámetros reproductivos.
Los datos extraídos de los estudios elegidos se registraron como sigue: especie, raza, alimentación diaria, efectos principales en variables reproductivas, tiempo de exposición en días, FEs presente en la alimentación y cantidad de FEs (mg/kg de MS).
Análisis de riesgo de sesgo
Los artículos incluidos se evaluaron por dos examinadores, a fin de esclarecer dudas emergentes, un tercero fue consultado para identificar la presencia de sesgo de aleatorización, de cegamiento, de reporte de resultados y otros (Cuadro 1). Para representar el análisis de sesgo, se propuso una escala de colores: si el estudio cumplía con el criterio descrito, se utilizó el color verde; si el estudio era poco claro o no se contaba con la suficiente información para la evaluación del sesgo, se utilizó el color amarillo.
Cuadro 1: Resumen de análisis de sesgo de cada estudio incluido
Referencia | Se describe de manera clara la selección aleatoria de la muestra de animales | Los investigadores que seleccionaron la muestra NO conocían a que tratamiento se asignaría ésta | Se aseguró cegamiento de evaluadores al tratamiento asignado | Los resultados están completos | El estudio está libre de otras fuentes de sesgo |
García et al., 2018(24) | |||||
Woclawek-Potocka et al., 2005(25) | |||||
Hashem et al., 2016(26) | |||||
Rodríguez et al., 2013(27) | |||||
Piotrowska et al., 2006(28) | |||||
Yurrita et al., 2017(29) | |||||
Cantero et al., 1996(30) | |||||
Pace et al., 2006(31) | |||||
Hashem et al., 2018(32) | |||||
Pace et al., 2011(33) | |||||
Aragadvay-Yungán et al., 2018(2) | |||||
Sierra et al., 2015(34) | |||||
Domínguez et al., 2014(19) | |||||
Ferreira-Dias et al., 2013(35) | |||||
Gentao et al., 1999(36) | |||||
Yuan et al., 2012(37) | |||||
Cardoso et al., 2007(38) | |||||
Cardoso et al., 2009(39) | |||||
Yousef et al., 2004(18) | |||||
Hashem et al., 2008(40) | |||||
Saleh et al., 2019(41) | |||||
Ni et al., 2007(42) | |||||
Lu et al., 2017(43) | |||||
Wistedt et al., 2012(44) | |||||
Arija et al., 2006(45) | |||||
Heng et al., 2017(46) |
El color verde indica bajo riesgo de sesgo, el color amarillo indica que no es claro o no hay suficiente información para la evaluación del criterio, según el juicio de los autores.
Resultados
En la búsqueda sistemática, se recopilaron finalmente 26 documentos especializados: seis de bovinos (un artículo en español y tres en inglés, una tesis de maestría en español y una tesis de doctorado en inglés); siete de ovinos (uno en español y cuatro en inglés, una tesis de maestría en español, un resumen de congreso en español); uno de equinos en inglés; dos de porcinos en inglés; cuatro de lepóridos en inglés y seis de aves en inglés (Cuadro 2). Todos los artículos fueron publicados entre 1996 y 2019.
Bovinos
En un estudio realizado con vaquillas Bradford (n=15 por grupo) de 11 meses de edad alimentadas, seis meses antes de su primer servicio, con 0.8 % de soya, calculado con base en el peso vivo (PV), (alimento que se consideró por los autores como con alto contenido de FEs, al compararlo con la alimentación habitual de 0.3 % PV), se observó un porcentaje de gestación (%G) de 93 % y un aborto, en comparación con el grupo testigo en donde se reportó un 100 % de éxito en la preñez y ningún caso de aborto; los autores aluden que no es posible afirmar que la alimentación con 0.8 % PV haya sido la causa del aborto, y que, dicha alimentación no afectó los parámetros reproductivos(24). En otro estudio, se evaluó el %G en vaquillas Holstein/Polish (75 y 25 %) que fueron alimentadas constantemente con 2.5 kg de soya, se observó que la tasa de la preñez, no fue significativamente diferente comparado con el grupo testigo, aunque se detectó equol y p-etil-fenol (compuestos derivados del metabolismo de los FEs) en el suero de las vaquillas(25). Por otro lado, se ha reportado que en vaquillas Holstein, alimentadas por cinco meses con trébol, el %G disminuyó (61.5 %), comparado con vaquillas alimentadas con ensilado de maíz (92.3 %); el porcentaje de vaquillas que no quedaron gestantes después de varias inseminaciones fue mayor (38.46 %) en el grupo de vacas alimentadas con trébol comparado con su testigo (7.7 % )(26) (Cuadro 2).
En vacas adultas Holstein/Polish (75 y 25 %) que fueron alimentadas desde un período de lactancia anterior al empadre, con 2.5 kg de soya, presentaron un %G de 60 % en comparación con el grupo control que mostró un 100 % de gestación(25). En vacas Holstein en etapa de lactancia alimentadas por 60 días con harina de alfalfa o trébol rojo, se reportaron alteraciones en las concentraciones de E2, progesterona (P4) y en la hormona luteinizante (LH). Se documentó disminución significativa de E2 en los grupos de vacas alimentadas con alfalfa (2.32 ± 0.12 pg/mL) o trébol rojo (2.25 ± 0.67 pg/mL) en comparación con las vacas testigo (4.24 ± 0.31 pg/mL); la concentración de P4 disminuyó al finalizar el período de suplementación en las vacas alimentadas con alfalfa (1.586 ± 0.27 ng/ml) o trébol rojo (0.988 ± 0.3 ng/ml) en comparación con los animales control (2.82 ± 0.34 ng/ml); la LH también disminuyó en las vacas de los grupos alimentados con alfalfa (3.82 ± 0.22 UI/ml) o trébol rojo (3.7 ± 0.26 UI/ml) comparada con las vacas control (6.66 ± 0.39 UI/ml)(27). En otro estudio se observó que las concentraciones de P4 disminuyeron a lo largo del ciclo estral en vacas Holstein/Polish black cuando se alimentaron con 2.5 kg de soya por 21 días, comparado con el grupo control, lo anterior sugiere que los FEs contenidos en la soya pueden alterar la función del cuerpo lúteo (CL), cabe mencionar que los efectos se comenzaron a observar entre el día 15 y 18 después de su ingesta(28) (Cuadro 2). En el único estudio disponible realizado en toros Angus, con una dieta con 10 % de soya desde el destete y hasta la pre-pubertad se observó una mejora en el crecimiento escrotal y la calidad del semen en la adultez(29).
Las diferencias entre sexos documentadas derivadas de los efectos producidos por FEs son biológicamente plausibles, dado que los FEs son xenoestrógenos conocidos que alteran el sistema endocrino dependiendo de la disponibilidad de REs y órganos blanco de ambos sexos. En los estudios revisados, la edad de exposición de FEs, y el tipo de FEs determinan el efecto biológico de los mismos, observando un efecto nocivo mayor en vacas adultas mantenidas con alimento rico en FEs que en las vaquillas.
Pequeños rumiantes
En ovejas Manchegas que consumieron alfalfa de forma ad libitum, durante 10 meses y que contenía COU a razón de 25 ppm en otoño, 30 ppm en invierno y 17 ppm en primavera, se encontró que el 43 % de éstas, presentaron alteraciones en el tracto genital: quistes o microquistes en el endometrio acompañadas de petequias y equimosis en la mucosa uterina, mayor actividad glandular y quistes paraováricos(30). Hay trabajos en los que no se documentan efectos nocivos sobre los parámetros reproductivos de ovejas y machos de la raza Comisana, incluso se ha sugerido que la administración prolongada de trébol subterráneo, con bajo contenido de formononetina (menor que 10 % del total de isoflavonas en base seca), induce una mejora significativa en la ganancia de peso de los animales y, en los machos, buenas características de la canal y la carne(31). En otro estudio llevado a cabo en ovejas gestantes de raza Rahmani, que fueron alimentadas durante dos meses previos al parto y hasta la inducción del siguiente celo (3.5 meses posparto) con 849.4 g/kg de MS de Trifolium alexandrinum, no se documentaron diferencias significativas entre grupos en la actividad ovárica y ovulación en el celo inducido, pero las hembras alimentadas con Trifolium alexandrinum mostraron menor duración de estro (20 h) en comparación con las ovejas alimentadas con maíz (34 h), en las cuales, las concentraciones de P4 en la fase lútea del estro inducido fueron significativamente mayores, en comparación con las ovejas tratadas(32).
En otro trabajo realizado en corderas de las razas Sarda y Comisana, se evaluaron los efectos de la alimentación ad libitum con alfalfa o trébol subterráneo, en estos animales, no se observaron alteraciones en el desarrollo del sistema reproductivo, fertilidad, fecundidad, rendimiento reproductivo, e intervalo entre partos, aunque los animales alimentados con trébol presentaron un mayor peso en la pubertad, los autores sugieren que algunas variedades de trébol no afectan negativamente la reproducción de las ovejas y parecen mejorar la tasa de crecimiento de los animales(33).
En carneros criollos alimentados con 1.1 kg/día de alfalfa contaminada con Pseudopeziza medicaginis en un 10, 40 y 70 % por 45 días, se documentó una disminución significativa de la concentración espermática en carneros alimentados con alfalfa contaminada con el hongo al 40 y 70 %, comparados con el grupo 10 %(2). Es preciso mencionar que las infestaciones fúngicas causadas por Pseudopeziza medicaginis incrementan las síntesis de sustancias fitoestrogénicas como coumarinas e isoflavonas(2). En otros estudios no se reportan diferencias entre características espermáticas, por ejemplo, en un estudio con ovinos híbridos Hampshire/Suffolk, que fueron alimentados con alrededor de 1 kg de alfalfa (2.5-6.5 mg de COU/100g de alfalfa(22,23)) o con 200 g soya extruida (57 mg de genisteína/100 g de soya extruída; 31 mg de daidzeína/100 g de soya extruida (22,23), diarios por 90 días, no se reportaron alteraciones en el volumen, color, motilidad, y concentración espermática evaluado en semen fresco o criopreservado(34). Asimismo, en corderos híbridos de tres meses Katahdin/Pelibuey alimentados por 90 días con 23 % de alfalfa, no se observaron diferencias en el volumen, ni en la integridad de la membrana espermática, la motilidad total, ni progresiva y en el estado del acrosoma(19) (Cuadro 2). En los ovinos, se encontraron contradicciones en cuanto a los efectos deletéreos o benéficos atribuidos a la ingestión de FEs sobre las variables reproductivas.
Equinos
Los efectos de FEs en los equinos provenientes de la alimentación están poco descritos. Se han identificado formas conjugadas y libres (activas) de COU y sus metabolitos en el plasma de yeguas alimentadas por 14 días con pellets de alfalfa en concentraciones crecientes hasta 1 kg/día, durante el tiempo del experimento, todas las yeguas ciclaron, en el día cero la mitad de las yeguas estaban en la fase folicular, y la otra mitad en la fase lútea, en los días 13 y 14 del experimento, todas las yeguas presentaron la fase lútea(35) (Cuadro 2). Los resultados sugieren que los FEs afectan la duración del ciclo estral y pueden prolongar la función lútea en la yegua, debido a la inducción de la persistencia de CL(35).
Porcinos
En cerdas gestantes alimentadas con una dieta regular suplementada con 0.005 mg de daidzeína/kg de PV, en el período de periparto (desde 30 días preparto al día 7 posparto), mostraron un incremento en el peso de la camada en comparación con el grupo control, que no consumió daidzeína; además, la producción de leche, proteínas del calostro y la hormona del crecimiento se incrementaron alrededor de un 12 % en aquellas cerdas alimentadas con dicha isoflavona(36). En minipigs alimentados con baja concentración de isoflavonas (250 ppm) no se observaron efectos negativos en la reproducción; en cambio, cuando aumentó la concentración (500 ppm) disminuyó el índice testicular ((peso testicular bilateral/total del peso corporal) x 100%), LH y testosterona (T4); además, hubo aumento de células germinales apoptóticas indicando peroxidación testicular(37) (Cuadro 2).
En cerdas, la alimentación suplementada con daidzeína favorece el peso de las crías al parto y la producción de leche, en el caso de los machos, el efecto de los FEs en la dieta depende de la cantidad administrada, cantidades bajas de FEs favorecen la función testicular.
Lepóridos
En un estudio realizado en conejas gestantes alimentadas con una dieta con 18 % de harina de soya (13 mg/kg de isoflavonas/de peso corporal) durante las etapas de gestación, lactancia y hasta la edad de 33 semanas de las crías, se observó que los machos fueron más precoces en el tiempo de inicio de la pubertad en comparación con el grupo testigo, no se reportaron diferencias significativas en la morfología de los órganos reproductivos, la calidad del semen y el comportamiento sexual(38). En otro estudio, se evaluó el efecto de la exposición a una dieta comercial para conejos con 18 % de harina de soya durante el período perinatal (intrauterino y lactancia) sobre la morfología de los órganos reproductivos de los machos, a las 26 semanas de edad. No se observaron alteraciones en el tracto reproductivo de la progenie masculina(39).
En conejos machos Nueva Zelanda, adultos de 7 meses, alimentados con 30 % de heno de Berseem (Trifolium alexandrinum) y suplementados con 2.5-5 mg de isoflavonas/kg de peso corporal cada tercer día durante 13 semanas, se documentaron mejoras en las características del semen y libido, ya que hubo un aumento en el volumen, concentración y el porcentaje de movilidad espermática(18). Cuando se evalúo el efecto de una dieta rica en soya (80 g de soya/kg de alimento) y en linaza (100 g de linaza/kg de alimento) en conejos adultos, se apreciaron incrementos en la ocurrencia de anormalidades en los espermatozoides, disminución en libido y en el proceso de la esteroidogénesis, sin embargo, cuando estos se cruzaron con hembras no tratadas, no se afectó la tasa de preñez, el tamaño de la camada y la fertilidad(40) (Cuadro 2).
Los resultados de los estudios anteriores sugieren que la administración del alimento comercial, con una concentración de hasta 18 % de soya, a conejas gestantes, no produce en las crías alteraciones en la morfología de los órganos reproductivos en los machos F1. Tampoco las dietas con porcentajes menores a 80 g de harina de soya o 100 g de linaza/kg de alimento, provocan efectos sobre los órganos reproductores de machos, el volumen del eyaculado ni la fertilidad. No se encontraron estudios en los que se evaluaran los efectos de los FEs directamente sobre la fisiología reproductiva de las hembras (Cuadro 2).
Aves
En un estudio realizado en gallinas ponedoras Bovans Brown(41) de 65 semanas de edad alimentadas por seis semanas con dietas suplementadas con 1 g de semillas de lino, o de fenogreco/kg de alimento (ricas en FEs, 0.20 mg de isoflavonas/kg de MS), se observó un aumento en la concentración de E2 y LH, peso y mejora del grosor del cascarón al final del ciclo de puesta de huevos, tanto con la suplementación de las semillas por separado, así como con su combinación (lino y fenogreco)(41). El aumento en el grosor del cascarón del huevo documentado en el estudio anterior, también se hizo presente en otro, en el que se alimentó a gallinas ponedoras ISA de 445 días de edad, con una dieta suplementada con 10 mg de daidzeína/kg de alimento(42). Además, en este último estudio se reportó un aumento significativo en la proporción del peso del oviducto con respecto al peso corporal(42). No se presentaron alteraciones en el ancho y largo del huevo, ni en las concentraciones séricas de E2(42). Por otro lado, se ha observado que en gallinas ponedoras Rugao de 44 semanas de edad alimentadas con dietas suplementadas desde 60 hasta 248 mg de daidzeína/kg de alimento durante 12 semanas, no generó diferencias significativas en la calidad del huevo ni en la fertilidad, aunque se observó incremento en la incubabilidad de la puesta de huevos(43). También, Wistedt et al(44) reportaron la ausencia de efectos en las variables reproductivas en gallinas ponedoras Lohmann Selected Leghorn (LSL) y Lohmann Brown (LB), de 15 semanas de edad sobre la morfología y tamaño de ovarios y oviductos después de haber sido suplementadas con 50 mg de daidzeína/kg de alimento. Se observó diferencia en la sensibilidad de las razas a la daidzeína, pues los cascarones de huevo fueron más gruesos en las LB que en las LSL(44). En pollos de engorda Cobb de 1 día de edad, alimentados durante 21 días con 100, 200 o 300 mg de frijol extruido o crudo/kg de alimento, se observó disminución en las concentraciones T4 y androstenediona con la alimentación de frijol crudo, en cambio, la administración de frijol extruido aumentó las mismas variables(45).
Finalmente, en gallos reproductores jóvenes de 70 días, alimentados con producto comercial adicionado con isoflavonas, se observó que con 5 mg/kg se incrementó el peso del testículo, la concentración de hormona liberadora de gonadotropinas (GnRH), y la expresión del ARNm de la enzima StAR(46) (Cuadro 2). Los resultados de los estudios sugieren que los FEs provocan efectos favorables en variables reproductivas de aves macho y hembras.
Sesgo
En ninguno de los estudios incluidos en la presente revisión, se realizó cegamiento de los evaluadores al tratamiento asignado, ni tampoco, en la selección de la muestra. En cambio, en todos los artículos se identificaron los resultados completos, y fueron libres de otras fuentes de sesgo. Más de la mitad de los estudios incluidos utilizaron alguna técnica de aleatorización para sus unidades experimentales(18,27,30,31,36,37,38,39,40,41,42,43,45,46).
Discusión
En rumiantes, las isoflavonas son metabolizadas en el rumen, lo que genera compuestos estrogénicos o no estrogénicos. El secoisolariciresinol y metairesinol son los precursores de COU, enterodiol y enterolactona; la biochanina A y la genisteína se pueden descomponer en p-etil-fenol (no estrogénico); la formononetina se metaboliza a daidzeína y finalmente a equol, un compuesto más estrogénico que se absorbe a través de la pared ruminal(47,48).
Los principales efectos producidos por los FEs en el ganado bovino incluyen: alteraciones hormonales, disminución de %G y aumento de abortos, esto depende de la etapa reproductiva, del tiempo de consumo y del tipo de FEs involucrado. La mortalidad embrionaria temprana y el incremento de la tasa de abortos puede ser explicada por la capacidad que poseen los FEs de inhibir la secreción de P4 estimulada por LH(49,50). En las vacas, la liberación de prostaglandinas (PG) con acción luteolítica, está regulada por E2 y P4(51). Los FEs y sus metabolitos activos alteran la relación PGE2-F2α lo que conduce a la producción no fisiológica de agentes luteolíticos durante la gestación y el ciclo estral(25). En la gestación, el equilibrio entre PGE2-F2α es crucial para el mantenimiento y función de CL, el reconocimiento de la preñez, la implantación embrionaria y el desarrollo, entonces, la estimulación de la producción de PGF2α puede llevar a interferir en dicho balance y el desarrollo embrionario(52). Los FEs como agonistas, en animales no preñados reducen la duración del ciclo estral, pues durante la luteolisis y la ovulación, la estimulación de la secreción de PGF2α puede acelerar la retroalimentación positiva entre PGF2α y oxitocina(51,52). Por otra parte, los FEs como antagonistas, inducen alteraciones en el desarrollo folicular y por lo tanto, la ausencia de estro(53,54). Además, se ha reportado una posible relación positiva entre la concentración de isoflavonas en el plasma sanguíneo y la incidencia de celo silencioso en el ganado lechero alimentado con soya(55).
Los FEs al ser parecidos estructuralmente al E2, actúan como agonistas o antagonistas de los REs(7,56). Los efectos biológicos atribuidos a los FEs se presentan con concentraciones de alrededor de 1,000 veces más altas que las concentraciones de E2 endógeno (1-10 nM). Lo anterior se basa en que Woclawek-Potocka et al reportaron 1.6 ± 0.3 μM de p-etil fenol y 1.2 ± 0.28 μM de equol(25); Piotrowska et al reportaron 1.28 ± 0.10 μM de equol y 6.24 ± 0.30 μM de p-etil fenol(28); Zdunczyk et al reportaron daidzeína, genisteína, equol y p-etil-fenol en un rango de 0.1 a 3.6 μmol/L en vacas que presentaron alteraciones reproductivas(55). En otro estudio, se calculó que la ingesta de 66.8 mg/kg de COU (presente en la alfalfa), produjo concentraciones plasmáticas de 13 ng/ml de este compuesto, que resulta ser también 1,000 veces mayor a la concentración de E2 durante el estro(25). Aún teniendo en cuenta que la actividad biológica del COU es 160 veces menor en comparación con la del E2, la cantidad equivaldría a seis veces la concentración efectiva de E2 en el estro, y por lo tanto, suficiente para inducir cambios estrogénicos semejantes a los encontrados en la vaca durante dicha fase del ciclo estral(57). Los datos anteriores sugieren que las vacas que están continuamente expuestas a una dieta que incluye FEs pueden mostrar alteraciones reproductivas, contrario a lo reportado en machos, en los cuales la alimentación con un 10 % de soya como fuente de proteína, mejora la formación y la concentración espermática(29).
En ovinos los efectos de los FEs sobre variables reproductivas son contradictorias. En algunos estudios se ha sugerido que, estos compuestos no provocan alteraciones como en otras especies(19,20); en otros, es evidente su efecto deletéreo, incluso se ha descrito el “Síndrome del Trébol” el cual consiste en infertilidad, prolapso de útero y distocia(58,59). Los principales efectos reportados en hembras son alteraciones morfológicas en órganos reproductivos y mayor actividad de las glándulas endometriales, lo que conduce a cambios cuantitativos y cualitativos del moco cervical, lo que puede dificultar la fertilización(30,60). Está reportado que los FEs sensibilizan al cuello uterino a la acción estrogénica, además de ocupar los REs en cérvix, también estimulan la aparición de nuevos sitios de unión(61). Además, los FEs alteran la secreción de la hormona folículo estimulante (FSH)(62). En ovejas, el número de folículos reclutables depende de las concentraciones de FSH(63), por lo tanto, es probable que los FE interfieran en el reclutamiento folicular.
Se ha reportado que los factores relacionados con la ausencia de efectos provocados por los FEs en algunos estudios son la estacionalidad, la dosis de FE ingerida y la especie y condiciones del vegetal utilizado, ya que se ha documentado que en una sola especie vegetal se puede encontrar más de un tipo de FEs en distintas concentraciones; por ejemplo; en condiciones normales, las concentraciones de COU en la alfalfa, son de 1 a 2 mg/kg y en circunstancias de defensa de la planta, la concentración de dicho FE, puede aumentar hasta 100 mg/kg(64). La concentración de FEs también depende de la presentación y órgano del vegetal, por ejemplo: el contenido de isoflavonas en los granos verdes crudos de soya, es de 48.9 mg/100 g de MS; el de la soya extruida es de 91 mg de/100 g de MS y la soya texturizada contiene 172.6 mg/100 g de MS(22,23). Con respecto a los flavonoides, las semillas maduras de soya contienen 37.41 mg/100 g de MS y las semillas verdes de soya contienen 1.23 mg/100 g de MS(22,23).
La transición de fotoperiodos contribuye a la regulación del comportamiento estral, la ovulación, disponibilidad de REs y concentración de esteroides endógenos(32). En ovinos, se ha sugerido, que una ingestión prolongada de trébol subterráneo con niveles de FEs inferiores al 0.3 % o ~10 mg/g MS de alfalfa no produce infertilidad ni trastornos reproductivos, incluso aumenta significativamente el crecimiento corporal(33), probablemente debido a que los FEs también estimulan la hormona de crecimiento(42,65). Se ha sugerido que las diferencias en los efectos deletéreos en la reproducción, se pueden deber al tipo de isoflavonas administradas, a la diferencia en el número de REs y el tipo de metabolismo entre las diferentes especies(66). En ovinos machos también se encontraron resultados contradictorios, Aragadvay et al(2) describen alteraciones reproductivas con la alimentación de alfalfa contaminada con Pseudopeziza medicaginis al 40 y 70 %; otros estudios no reportan efectos nocivos(19,34). La razón por la cual existe esta diferencia en los resultados, aún no está descrita, probablemente se deba a la diferencia en la sensibilidad de los compuestos esteroidogénicos entre las razas de la misma especie, así como está reportado en otros modelos animales(67) incluso, es probable que los ovinos machos sean menos susceptibles al efecto de los fitoestrógenos(20) o que algunas variedades de vegetales no afectan negativamente la reproducción de las ovejas(20,33).
De acuerdo con los criterios establecidos en la presente revisión, no se encontraron estudios publicados relacionados con cabras. Sin embargo se ha reportado que cabras alimentadas constantemente con 30% de alfalfa deshidratada presentaron una incidencia del 20 % de prolapsos rectales o vaginales en el último mes de gestación(68).
En un reporte de caso de yeguas alimentadas con 5-8 kg/día de mezcla heno de alfalfa y trébol por al menos cinco meses, se observó edema uterino, ausencia de ovulación, y acumulación de fluido uterino, retorno a la ciclicidad ovárica normal dentro de las 2 a 3 semanas posteriores al retiro del alimento rico en FEs(35). El mecanismo de la absorción de FEs no está totalmente descrito; en esta especie, la digestión es muy rápida y el alimento puede pasar a través del estómago y el intestino delgado, dentro de las primeras 5 h(69). Lo anterior fue comprobado en un estudio en el que las formas activas de COU alcanzaron su nivel más alto entre 1 y 3.5 horas después de su ingestión(35). La cantidad de FEs en la pastura depende de la temporada del año, ya que se encontró una disminución de COU y sus metabolitos cuando se evaluó de noviembre a marzo y se sabe que su síntesis se incrementa bajo condiciones adversas para las plantas(35). Cabe mencionar que la deshidratación de la alfalfa para producir pellets podría reducir la actividad estrogénica(70). Por lo anterior, el tiempo de exposición, la presentación de FEs y la temporada del año, es fundamental para la producción de los efectos.
Los efectos de los FEs, presentes en la dieta de porcinos sobre variables reproductivas es escaso, en contraste con la cantidad de datos de efectos estrogénicos de alimento contaminado con micotoxinas, o trabajos en los que se estudia el efecto de isoflavonas en la calidad de la carne y el crecimiento(71-73). La daidzeína y la genisteína, son las principales isoflavonas contenidas en la harina de soya, que es el ingrediente proteico básico en la dieta de los porcinos y se conoce que ambas representan el 88 % de las isoflavonas circulantes en sangre(73). Uno de los efectos de la alimentación de cerdas con dietas que contienen FEs en el último tercio de gestación, es un incremento en el peso de los animales, esto se puede deber al efecto positivo que producen los FEs sobre las concentraciones de hormona del crecimiento(74). En machos, el efecto es mucho más evidente, pues en la etapa fetal las concentraciones de estrógenos circulantes son bajas, y la presencia de FEs estimularía el crecimiento debido a un cambio en el metabolismo, proliferación y diferenciación del músculo esquelético(75). El aumento en la producción y la mejor calidad de la leche en cerdas alimentadas con isoflavonas, se podría deber al efecto agonista de las mismas sobre el factor de crecimiento insulínico-1 (IGF-1) y la prolactina reportado en cerdas periparturientas(76) o a un mejor balance de antioxidantes(77). En los machos, se ha identificado un efecto positivo en la reproducción cuando se administran bajas concentraciones de FEs(37). Lo anterior, se ha atribuido a la unión de las isoflavonas a los REs en el hipotálamo, hipófisis y testículos, estimulando la espermatogénesis, maduración espermática y el crecimiento gonadal(6).
En cuanto a los lepóridos, está reportado que las hembras son más sensibles al efecto de los estrógenos ambientales(38). En conejos machos la administración intrauterina y lactacional de los FEs no inducen efectos deletéreos en la producción de semen o el comportamiento sexual, incluso se ha sugerido que la harina de soya se puede utilizar como parte de la dieta normal en hembras preñadas sin daño reproductivo a la progenie(38,39). La influencia benéfica de las isoflavonas en los parámetros seminales se han atribuido a su efecto antioxidante, debido a que reducen la producción del peróxido de hidrógeno y protegen a los espermatozoides contra el daño oxidativo(18). Además, en machos adultos, el estrógeno juega un papel principal en la prevención de la apoptosis en células germinales a través de sus acciones parácrinas o autócrinas en los testículos(32). El tipo de FEs que consumen los conejos también influye en el efecto final, por ejemplo, los lignanos suprimen con mayor fuerza la síntesis de T4 durante la espermatogénesis y la líbido, en comparación con las isoflavonas(32).
En aves, al igual que en los otros animales domésticos, los FEs pueden actuar como agonistas/antagonistas, dependiendo de la dosis, tipo de tejido, el subtipo de RE, y presencia de hormonas endógenas, por lo tanto son considerados moduladores selectivos de REs(78). En aves, los efectos producidos por el consumo de FEs están relacionados con el componente genético, pues líneas de gallinas LB y LSL mostraron sensibilidad distinta a dichos compuestos(44); esto, podría deberse a que hay diferencia en la localización y en la expresión de los REs ß en los capilares uterinos entre líneas genéticas, lo que podría influenciar en la obtención de mayor peso del oviducto(44).
En aves machos, se observó que una dieta rica en FEs promueve el crecimiento testicular por el incremento de la secreción hormonal, probablemente debido a la participación regulatoria de las isoflavonas en el mecanismo de retroalimentación del eje hipotálamo-hipófisis-gónada(79), lo que a su vez regula la secreción de FSH, LH y T4 que promueve el crecimiento y la maduración de las células de Sertoli y Leydig. La dosis administrada también tiene un papel importante, está documentado que la genisteína tiene efectos agonistas parciales en gallos a dosis de 50-200 mmol/kg, y a dosis de 400-500 mol/kg actúa como antagonista(78); además, los FEs tienen la capacidad de inhibir la actividad de enzimas esteroidogénicas, e influyen en la viabilidad de las hormonas sexuales a través de la regulación de sus proteínas de unión; alteran centros cerebrales relacionados con el comportamiento sexual ya que atraviesan la barrera hemato-encefálica y se unen al RE α y ß(80).
Finalmente, el metabolismo de FEs dietarios es predominantemente determinado por el metabolismo bacteriano gastrointestinal y depende de la etapa reproductiva, por ejemplo durante la gestación, la genisteína tiene el potencial de influir en el metabolismo y el crecimiento fetal; en el colon, la genisteína se puede metabolizar a dihidrogenisteína o 6'-hidroxi-O-desmetilangolensina, mientras que la daidzeína se puede reducir a dihidrodaidzeína y convertirse en O-desmetilangolensina o equol, dichos metabolitos, pueden absorberse o metabolizarse en fenoles en la luz del colon(81). Luego del consumo de los FEs, estos son des-conjugados por la flora bacteriana intestinal, reabsorbidos, re-conjugados en el hígado y excretados en la orina(25,61). La desmetilación de estos compuestos ocurre en el intestino por bacterias acetogénicas y en el hígado(81). Por lo tanto, el microbioma intestinal presente en cada especie influirá en el efecto final de los FEs sobre las variables productivas y reproductivas.
Conclusiones
Con base en los artículos revisados y discutidos, se concluye que, los fitoestrógenos provocan alteraciones en la fisiología reproductiva de los animales de abasto considerando cuatro factores: 1) la especie vegetal consumida; 2) la temporada del año en que se consume la especie vegetal; 3) las particularidades de los animales (metabolismo, edad, raza, especie y sexo) y 4) las condiciones de procesamiento de la planta. Futuros estudios deben ser llevados a cabo para dilucidar los mecanismos endocrinos de las acciones de FEs en la reproducción de animales. Es necesario reevaluar los ingredientes que componen los alimentos de los distintos animales productivos.
Literatura citada:
Cuadro 2: Resumen de los principales efectos de los fitoestrógenos (FEs) en especies productivas
Especie | Condición y raza | Ingesta diaria | Efectos principales | Exposición (días) | Cantidad de FEs de acuerdo con la especie y presentación del vegetal (mg/kg de MS) | Autores y año |
Bovinos | Adultas Holstein/Polish | 2.5 kg de soya | Disminución de %G | 300 | 1900 de GEN y DAI | Woclawek-Potocka et al., 2005(25) |
Adultas Holstein | ~5 kg de alfalfa | Aumento de E2, disminución de P4 y LH | 60 | ~25-65 de COU | Rodríguez et al., 2013(27) | |
Adultas Holstein | ~5 kg de trébol rojo | Aumento de E2, disminución de P4 Y LH | 60 | ~100 de GEN y 110 de DAI | Rodríguez et al., 2013(27) | |
Adultas Holstein/Polish | 2.5 kg de soya | Disminución de P4 | 21 | 1900 de GEN y DAI | Piotrowska et al., 2006(28) | |
Vaquillas Bradford | 2.22 kg de soya | Disminución de %G, aumento de abortos, no significativo | 300 | ~570 de GEN y 310 de DAI | García et al., 2018(24) | |
Vaquillas Holstein/Polish | 2.5 kg de soya | Sin diferencia en %G | 21 | 1900 de GEN y DAI | Woclawek-Potocka et al., 2005(25) | |
Vaquillas Holstein | ~7 kg de trébol | Disminución de %G y P4 Aumento de E2 | 150 | 6.60 de GEN, 8.05 de DAI, 2.85 de FOR y 282.5 de BI | Hashem et al., 2016(26) | |
Becerros Angus | ~800 g de harina de soya | Aumento en concentración espermática | 360 | ~135 de GEN y 6.32 de DAI | Yurrita et al., 2017(29) | |
Ovinos | Adultas Manchegas | Ad libitum pastura de alfalfa | Quistes endometriales y paraováricos | 300 | 17-30 de COU | Cantero et al., 1996(30) |
Adultas Rahmani | 800 g de trébol subterráneo | Menor duración del estro | 180 | 6.60 de GEN, 8.05 de DAI, 2.85 de FOR y 265 de BI | Hashem et al., 2018(32) | |
Corderas Comisana | Ad libitum pastura trébol subterráneo | Sin efectos en reproducción | 60 | 797 de GEN, DAI, FOR y BI | Pace et al., 2006(31) | |
Corderas Sarda | Ad libitum pastura de alfalfa | Sin alteraciones en sistema reproductivo, fertilidad, y fecundidad | 60 | 900–10210 de GEN, BI y FOR | Pace et al., 2011(33) | |
Corderas Sarda | Ad libitum pastura de trébol subterráneo | Sin alteraciones en sistema reproductivo, fertilidad, y fecundidad | 60 | 900–10210 de GEN, BI y FOR | Pace et al., 2011(33) | |
Corderas Comisana | Ad libitum pastura trébol subterráneo | Sin alteraciones en parámetros reproductivos | 600 | 810-880 de GEN, BI y FOR | Pace et al., 2011(33) | |
Adultos Criollos | ~1 kg de alfalfa | Concentración espermática inverso a dosis | 45 | ~25-65 de COU | Aragadvay-Yungán et al., 2018(2) | |
Adultos Hampshire/Suffolk | 1 kg de harina de alfalfa | Sin alteraciones en parámetros espermáticos | 90 | ~25-65 de COU | Sierra et al., 2015(34) | |
Adultos Hampshire/Suffolk | 200 g de soya extruida | Sin alteraciones en parámetros espermáticos | 90 | ~570 de GEN y 310 de DAI | Sierra et al., 2015(34) | |
Corderos Katahdin/Pelibuey | ~230 g de alfalfa | Sin alteraciones en parámetros ni morfología espermática | 90 | ~25-65 de COU | Domínguez et al., 2014(19) | |
Corderos Comisana | Ad libitum pastura trébol subterráneo | Sin efectos en reproducción | 60 | 797 de GEN, DAI, FOR y BI | Pace et al., 2006(31) | |
Equinos | Adultas Lusitanas | 1 kg de pellets de alfalfa | Altas concentraciones de COU en suero | 14 | ~25-65 de COU | Ferreira-Dias et al., 2013(35) |
Porcinos | Gestantes Large White/Erhualian | ~1.5 mg de DAI | Incremento en producción de leche | 37 | - | Gentao et al., 1999(36) |
Adultos Minipig | ~6.75–27 mg de isoflavonas de soya | En dosis bajas aumento de índice testicular, en dosis altas disminución del índice testicular, LH y T4 | 60 | 125-500 de ISO | Yuan et al., 2012(37) | |
Lepóridos | Gestantes Nueva Zelanda | ~20 g de harina de soya | Sin efecto en órganos reproductivos, calidad seminal y comportamiento sexual de F1 | ~256 | ~135 de GEN y 632 de DAI | Cardoso et al., 2007(38) |
Adultos Nueva Zelanda | ~32 g de harina de soya | Sin alteraciones en órganos reproductivos | 60 | ~135 de GEN y 632 de DAI | Cardoso et al., 2009(39) | |
Adultos Nueva Zelanda | 7.13–14.25 mg de ISO* | Mejora en características del semen y libido | 91 | - | Yousef et al., 2004(18) | |
Adultos Línea V | ~15.44 g de soya | No afecta fertilidad de semen, disminución de T4 | 84 | 240.4 de DAI y 131 de GEN | Hashem et al., 2018(40) | |
Adultos Línea V | ~19.3 g de linaza | No afecta fertilidad de semen, disminución de T4 | 84 | 368 de SECOI y 52.8 de DAI | Hashem et al., 2018(40) | |
Aves | Adultas Bovans Brown | ~120 mg de lino | Aumento de LH, FSH, E2 | 42 | - | Saleh et al., 2019(41) |
Adultas Bovans Brown | ~131 mg de fenogreco | Aumento de LH, E2 | 42 | ~0.1 de DAI y 0.1 GEN | Saleh et al., 2019(41) | |
Adultas Bovans Brown | ~128 mg de lino y 128 mg de fenogreco | Aumento de LH, FSH, E2 | 42 | ~0.1 de DAI y 0.1 GEN | Saleh et al., 2019(41) | |
Adultas ISA | ~1.2 mg de DAI | Aumento en peso del oviducto | 63 | - | Ni et al., 2007(42) | |
Adultas Rugao | ~5.4–22.57 mg de DAI | Sin efecto en fertilidad | 84 | - | Lu et al., 2017(43) | |
Adultas Lohmann Brown | ~5 mg de DAI | Sin cambios en morfología tamaño de ovarios y oviductos alta sensibilidad a DAI | 84 | - | Wistedt et al., 2012(44) | |
Adultas Selected Leghorn | ~5 mg de DAI | Sin cambios en morfología y tamaño de ovarios y oviductos | 84 | - | Wistedt et al., 2012(44) | |
Jóvenes Reproductores | ~0.75 mg de ISO | Incremento en peso del testículo, GnRH | 63 | - | Heng et al., 2017(46) | |
Pollos Cobb | ~2.38-7.14 mg de frijol extruido | Aumento de T4 y androstenediona | 21 | - | Arija et al., 2006(45) | |
~2.38-7.14 mg de frijol crudo | Disminución de T4 y androstenediona | 21 | - | Arija et al., 2006(45) |
BI= Biochanina A; COU= Coumestrol; DAI= Daidzeína; E2= 17-ß estradiol; FOR= Formonoteina; F1= Generación filial 1; GEN= Genisteína; GLY= Gliciteína; GnRH= Hormona liberadora de gonadotropinas; ISO= Isoflavonas; LH= Hormona luteinizante; MCOU= Metoxicoumestrol; PEP= Para-etil-fenol; P4= Progesterona; SECOI= Secoisolariciresinol; T4= Testosterona; %G= Porcentaje de gestación; -= No aplica; *= Cada tres días; ~= cálculo aproximado.