Rocío Rodríguez-Gallegos a
Gregorio Álvarez-Fuentes b
Juan Antonio Rendón-Huerta a*
Juan Ángel Morales-Rueda a
Juan Carlos García-López b
Luis Alberto Olvera-Vargas c
a Universidad Autónoma de San Luis Potosí. Coordinación Académica Región Altiplano Oeste. Carretera Salinas-Santo Domingo #200, 78600, Salinas de Hidalgo, San Luis Potosí, México.
b Universidad Autónoma de San Luis Potosí. Instituto de Investigación de Zonas Desérticas. San Luis Potosí. México.
c Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, A.C. Jalisco, México.
*Autor de correspondencia: antonio.rendon@uaslp.mx
Resumen:
El objetivo de este trabajo fue evaluar la carga microbiológica de coliformes totales (CT), Staphylococcus aureus y Salmonella spp en leche y quesos frescos como indicadores de prácticas de proceso que se realizan en queserías de diferentes localidades de la región de Salinas, San Luis Potosí. Se muestrearon 15 establecimientos, se obtuvieron muestras de leche y queso y se les realizó un análisis de composición de la leche y microbiológico. El 65 % de las unidades de producción no pasteuriza la leche o utiliza cuajo natural. Los conteos más elevados en leche fueron de 42 x 109 y 40 x 109 UFC/ml para S. aureus y CT, respectivamente. Para queso, las cuentas de 32 x 109 y 26 x 109 UFC/g para S. aureus y CT, respectivamente. Además, se detectó presencia de Salmonella en leche y queso. Se concluye que la falta de higiene en los utensilios y equipos en los que se elaboran los quesos, así como el uso de cuajo natural, pueden ser un riesgo para la salud del consumidor.
Palabras clave: Zoonosis, Bacteria, Salud pública, Leche de vaca, Leche de cabra.
Recibido: 10/07/2020
Aceptado: 24/09/2021
Introducción
La leche por sus características nutricionales es uno de los alimentos de origen animal con mayor demanda el mundo. En México en el año 2018, la producción de leche fue de 12,008,239 miles de litros, de los cuales alrededor del 73 % se destinó a la elaboración de productos y derivados lácteos (8,784,055 miles de litros)(1). La región del Altiplano Oeste del Estado de San Luis Potosí se caracteriza por ser una región productora de leche en mayor proporción de bovinos y en menor de caprinos, en la que la mayoría de la leche se destina a la elaboración de queso fresco artesanal. Los quesos artesanales tradicionales son importantes, no únicamente por sus bondades nutricionales y gustativas, sino por su capacidad para generar y mantener el empleo rural que involucra algunos agentes de la cadena agroindustrial de leche; ganaderos, queseros y comerciantes(2). Sin embargo, se requiere organización entre productores para, por ejemplo, crear una “denominación artesanal” con un nivel de regulación y protección, que garantice la preservación de sistemas productivos lecheros basados en prácticas tradicionales y sus respectivos beneficios socioeconómicos(3).
Por otro lado, en estas unidades de producción (UP) del Altiplano Oeste de San Luis Potosí, el queso se elabora a partir de leche cruda, con el uso de métodos tradicionales no estandarizados, escasa tecnificación y en instalaciones no apropiadas (ej., utilizan las cocinas de las viviendas de los productores). Al respecto, la mayoría de los productores desconocen el concepto de buenas prácticas de manufactura y el proceso de pasteurización, el cual es un proceso térmico que permite controlar bacterias patógenas que en la actualidad se encuentran en la leche como Mycobacterium tuberculosis, Listeria monocytogenes, al igual que algunas especies de Campylobacter, Salmonella, Escherichia coli y otros coliformes fecales(4). Además, la contaminación cruzada de la leche después de la pasteurización debe controlarse aplicando reglas estrictas de limpieza y desinfección(5). Asimismo, en este tipo de UP, en ocasiones la elaboración de queso se utiliza cuajo natural no estéril, su elaboración consiste en secar bajo el sol hasta por tres días fragmentos extendidos de abomaso de becerros recién nacidos en tendederos, posteriormente se introducen en un tambo de plástico con suero de leche, se tapa y se deja fermentar por al menos cinco días para su posterior uso; esta práctica puede ser un punto importante de contaminación microbiana.
Las enfermedades gastrointestinales por el consumo de alimentos contaminados pueden presentarse en cualquier época del año, pero el riesgo se incrementa en época de calor. Los cuadros clínicos más frecuentes son fiebre, vómito, dolor abdominal y diarrea moderada o intensa(6). Para instituciones de salud como es el Instituto Mexicano del Seguro Social (IMSS) estas enfermedades son; brucelosis, cólera, tifoidea, gastroenteritis, shigelosis, salmonelosis y diarrea, lo cual representan un severo problema de salud pública para San Luis Potosí y el país(7,8). Por lo que, los productos lácteos deben cumplir con las disposiciones y especificaciones sanitarias de la NOM 243(9). La cual indica que Salmonella spp debe estar ausente en 25 g de queso o mililitro de leche, para coliformes totales se permite un máximo de 100 unidades formadoras de colonias por gramo o mililitro (UFC/g o ml) y para Staphylococcus aureus un máximo permitido de 1,000 UFC/g. Por lo anterior, el objetivo del presente trabajo fue evaluar la carga microbiológica de coliformes totales, S. aureus y Salmonella spp en leche y quesos como indicadores de las prácticas de proceso que se realizan en las queserías de diferentes localidades de la región de Salinas, San Luis Potosí, y poder recomendar buenas prácticas de manufactura que coadyuven a mejorar las condiciones salubres de elaboración, sin alterar las características del producto lácteo.
Material y métodos
Sitio de muestreo
El estudio se realizó en los meses de enero a abril del 2018 en una porción de la región Altiplano Oeste del Estado, en algunas localidades del municipio de Salinas, San Luis Potosí y de Villa González Ortega, Zacatecas, los cuales se localizan entre las siguientes coordenadas: 101º43" O y 22º38" N, con una altura de 2,070 msnm, cuyo clima es seco y temperatura media de 18 °C(10).
Se realizaron visitas de campo a diversas localidades de la región productoras de quesos de vaca y cabra. Siguiendo las recomendaciones del proyecto de NOM 109(11), se tomaron muestras de leche de la primera ordeña del día y queso fresco molido en 15 UP diferentes. Se tomaron tres alicuotas de 10 ml de leche del tanque o bote (40 L) acumulada del día y se colocaron en frascos estériles. Tres muestras de 50 g aproximadamente de diferentes quesos se colocaron en bolsas individuales de cierre hermético tipo ziploc. Las muestras de leche y queso se colocaron en una hielera de plástico, previamente sanitizada y desinfectada con alcohol para evitar contaminación cruzada, la cual contenía hielo para control de la temperatura. Inmediatamente después, se trasladaron al laboratorio para su análisis composicional y microbiológico.
Dos muestras de leche y dos muestras de queso comercial se utilizaron como tratamiento testigo. Además, en los sitios muestreados se aplicó una encuesta para obtener información de las condiciones en las que se producen y elaboran los derivados lácteos.
Composición de la leche
Las muestras de leche se analizaron con un equipo lactoscan (Milkotester, Master Eco) con sensores ultrasónicos para determinar contenido en porcentaje de grasa, proteína, lactosa, sólidos no grasos, sales, punto de congelación, densidad y agua agregada.
Análisis microbiológico
Se prepararon los agares RVBA (rojo-violeta-bilis-lactosa, BD-BIOXONTM), Salmonella-Shigella (BD-BIOXONTM), Baird Parker (BD-BIOXONTM), de acuerdo con las instrucciones de esterilidad que indica cada uno de los recipientes, para el crecimiento de microorganismos específicos, tales como; coliformes totales, Salmonella spp. y Staphylococcus aureus, respectivamente.
En laboratorio, las muestras de leche y queso se prepararon mediante el método de diluciones en agua peptonada de acuerdo con la NOM 110(12). Para muestras sólidas, se tomó una muestra de 1.0 g de queso, se diluyó y mezcló homogéneamente en 9 ml de caldo lactosado o agua peptonada al 0.1% para triturar el sólido, esto constituyó la primera dilución de la muestra (101). Posteriormente, por cada muestra se prepararon 10 tubos de 20 ml, en el primer tubo se colocaron 10 ml de la mezcla y los tubos del dos al diez contenían 9.0 ml de agua peptonada al 0.1%, en seguida se tomó 1.0 ml de la dilución inicial del primer tubo y se mezcló homogéneamente en el segundo tubo, el procedimiento se repitió hasta el tubo nueve (109).
Para muestras líquidas (leche) se prepararon 10 tubos de 20 ml previamente esterilizados, se tomó una muestra de 10 ml leche y se vació en el primer tubo (100), los tubos del dos al diez contenían 9.0 ml de agua peptonada al 0.1%, en seguida se tomó 1.0 ml de leche del primer tubo y se mezcló homogéneamente en el segundo tubo, el procedimiento se repitió hasta el tubo nueve (109). Una vez terminadas las diluciones, se utilizó la técnica descrita por Miles y Misra, modificada por Slack y Wheldon(13), en la cual se depositaron 20 μl de cada dilución en la superficie de una placa de agar para cuenta en placa, realizando el goteo desde una altura de 2.5 cm y depositando tres gotas por cada dilución. Para la presencia de Salmonella en queso y leche, se tomó una muestra de 25 ml de leche o 25 g de queso, se diluyó y mezcló homogéneamente en 225 ml de caldo lactosado o agua peptonada al 0.1% para triturarlo y se incubo por 18 h a 36 °C, esto constituyó la primera dilución de la muestra (101). Se verificó con la NOM 114(14) en agar Salmonella-Shigella y se colocaron en incubadora (Yamato IN 804) por 24 h a 35 °C, colonias translúcidas, ocasionalmente opacas, algunas colonias con puntos negros en el centro. Para determinar la presencia de S. aureus se siguieron las directrices de la NOM 115(15) usando agar Baird Parker (+Telurito de potasio) e incubando a 35 °C por 48 h, se seleccionan las placas que tengan entre 15 y 150 colonias de color negro y la presencia de coliformes totales se analizó con la NOM 113(16) usando agar rojo-violeta-bilis-lactosa (RVBA) y se incubaron a 35 °C por 24 h, se seleccionan las placas que tenían entre 15 y 150 colonias de color rojo oscuro.
Análisis estadístico
Se obtuvieron los estadísticos descriptivos para los parámetros de calidad de la leche resultado del análisis fisicoquímico; se clasificó a las unidades de producción mediante un análisis clúster con la función hclust que agrupa a los establos similares y los disimilares; para comparar los grupos clúster resultantes se realizó un análisis de varianza para un diseño completamente al azar; cuando éste indicó que había efecto de tratamiento (P<0.05), se realizó de una prueba de medias de Tukey con una significancia de P<0.05. Los datos del análisis microbiológico UFC/g o ml de queso o leche que contenían Salmonella spp, coliformes totales y S. aureus se obtuvieron sus estadísticos descriptivos. Para analizar los datos se utilizó el software estadístico R Core Team(17).
Resultados
Características de las unidades de producción
De las quince unidades de producción (UP), tres únicamente son de cabra y el resto de vaca como se describe en el Cuadro 1. Las UP con vacas, cuentan en promedio con 17.3 ± 14.2 cabezas, de las cuales 7.5 ± 6 son vacas de ordeño con una producción de 7.08 ± 2.71 L/día. Las tres unidades de producción con cabras en promedio cuentan con 45 ± 5 cabezas, de las cuales 25 ± 5 son cabras de ordeño, con una producción promedio de 1.0 ± 0.5 L/día. La ordeña se realiza de manera manual dos veces al día, por la mañana y por la tarde.
Cuadro 1: Localidades muestreadas, número de vacas y cabras por establo, ordeño y producción de leche al día
Unidad de producción | Localidad | Total, animales | Animales en ordeño | Producción L/animal*d | Especie |
1 | Punteros* | 35 | 25 | 4.0 | Vaca |
2 | El Potro* | 8 | 8 | 11.0 | Vaca |
3 | El Potro* | 11 | 7 | 8.0 | Vaca |
4 | El Potro* | 13 | 10 | 10.0 | Vaca |
5 | El Alegre* | 40 | 20 | 1.5 | Cabra |
6 | El Alegre* | 50 | 30 | 0.7 | Cabra |
7 | El Alegre* | 45 | 25 | 0.5 | Cabra |
8 | Salinas* | 8 | 7 | 5.0 | Vaca |
9 | Salinas* | 6 | 4 | 8.0 | Vaca |
10 | El Refugio ** | 50 | 7 | 6.0 | Vaca |
11 | El Refugio ** | 2 | 1 | 4.0 | Vaca |
12 | El Refugio ** | 30 | 3 | 5.0 | Vaca |
13 | El Refugio ** | 9 | 5 | 4.0 | Vaca |
14 | Zumpango** | 20 | 8 | 10.0 | Vaca |
15 | Zumpango** | 15 | 5 | 10.0 | Vaca |
*Salinas de Hidalgo; ** Villa González Ortega, Zacatecas.
Composición de la leche
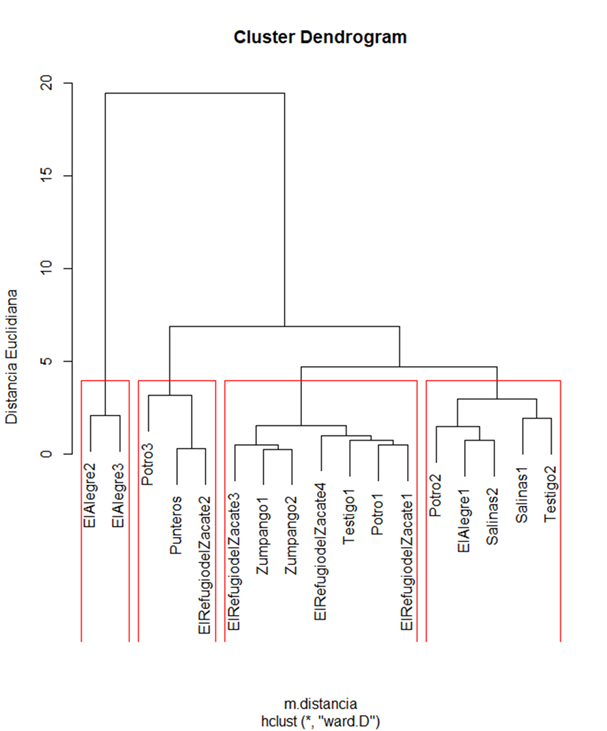
Derivado del análisis clúster (Figura 1) se identificaron cuatro grupos los cuales se detallan en el Cuadro 2, dando como resultado cuatro grupos, separando en el grupo I donde se encuentran las UP que cuentan con cabras principalmente de raza Saanen, dicha agrupación se basa al contenido similar de nutrientes en leche. En porcentaje de grasa, el clúster I mostró diferencia estadística (P<0.05) en contraste con los otros grupos (muestras de leche de vaca) los cuales muestran cierta similitud entre ellos. El porcentaje de proteína, lactosa, sólidos no grasos y sales no presentó diferencia (P>0.05) entre grupos. En la variable sólidos totales se presentaron diferencias significativas entre clusters (P<0.05) el valor mayor se obtuvo en el clúster I (14.5 %) por ser leche de cabra y el menor valor lo presentó el cluster IV (10.8 %). La variable densidad mostró diferencias estadísticas, los grupos de muestras de leche de vaca (cluster II, III y IV) obtuvieron el valor más alto (1024 kg/m3) y fueron estadísticamente iguales, en contraste, el cluster I presentó un valor promedio de 1,019 kg/m3. Finalmente, el punto crioscópico en el clúster I se vio disminuido, como resultado de un mayor contenido de lactosa y sales en la leche.
Figura 1: Dendograma del análisis fisicoquímico de la leche de vaca y cabra
Cuadro 2: Composición nutricional de las muestras de leche
Variable | Clúster I | Clúster II | Clúster III | Clúster IV | P-valor |
Grasa, % | 6.3 ± 0.71a | 4.3 ± 0.53b | 3.3 ± 0.25bc | 2.7 ± 0.65c | *** |
Proteína, % | 3.2 ± 0.07 | 3.1 ± 0.12 | 3.1 ± 0.21 | 2.9 ± 0.22 | N.S. |
Lactosa, % | 5.0 ± 0.07 | 4.7 ± 0.23 | 4.5 ± 0.19 | 4.5 ± 0.30 | N.S. |
Sólidos totales, % | 14.5 ± 0.57a | 13.0 ± 0.15b | 11.7 ± 0.26c | 10.8 ± 0.48d | *** |
Sólidos no grasos, % | 9.0 ± 0.13 | 8.7 ± 0.4 | 8.5 ± 0.12 | 8.4 ± 0.51 | N.S. |
Densidad, kg/m3 | 1018.8 ± 1.1b | 1024.8 ± 1.2a | 1024.3 ± 0.2a | 1023.5 ± 0.8a | *** |
Sales, % | 0.7 ± 0.0 | 0.67 ± 0.06 | 0.69 ± 0.04 | 0.64 ± 0.05 | N.S. |
Punto crioscópico, °C | -0.62 ± 0.01b | -0.55 ± 0.03a | -0.53 ± 0.02a | -0.53 ± 0.04a | ** |
abc Valores medios con distinta literal son diferentes estadísticamente (P<0.05) por renglón.
N.S. = no significativo; ** = P<0.001; *** = P<0.0001.
Análisis microbiológico
Leche
Las especificaciones de calidad microbiológica de los productos lácteos que establece la NOM 243(7), es igual para los productos de leche de vaca, oveja y cabra. Los resultados del análisis microbiológico de las muestras de leche se pueden observar en el Cuadro 3. Resulta evidente que aquellos productores que realizan un proceso térmico para evitar la descomposición de la leche, que consiste en hervir la leche, dejar enfriar a temperatura ambiente y posteriormente refrigerarla (pasteurización sin control), muestran las cargas microbianas más bajas, en comparación con los que no realizan un proceso térmico.
Cuadro 3: Análisis microbiológico (UFC/ml) de muestras de leche en distintas queserías de Salinas, S.L.P. y Villa González, Zacatecas
Unidad de producción | S. aureus | CT | Salmonella spp | Pasteuriza la leche |
1 | 10x101±1x10 | 12x101±1x10 | Ausente | No |
2 | Ausente | Ausente | Ausente | Si |
3 | 77x102±1x102 | 29x101±3x10 | Presente | Si |
4 | 43x102±5x101 | 13x103±2x102 | Ausente | Si |
5 | 36x104±5x103 | Ausente | Presente | Si |
6 | 40x104±1x103 | 21x105±7x104 | Presente | No |
7 | 36x101±1x10 | 24x105±4x104 | Presente | No |
8 | 32x108±4x107 | Ausente | Presente | No |
9 | 43x107±5x106 | 12x108±2x107 | Presente | No |
10 | 40x101±1x10 | 80x102±1x102 | Presente | No |
11 | 67x102±5x101 | 37x106±1x106 | Presente | No |
12 | 12x103±2x102 | 40x109±1x108 | Presente | No |
13 | 72x107±1x107 | 24 x105±6x104 | Presente | No |
14 | 42x109±4x108 | 57 x108±5x107 | Presente | No |
15 | 13x103±2x102 | 25 x103±2x102 | Presente | No |
T1 | Ausente | Ausente | Ausente | Si |
T2 | Ausente | Ausente | Ausente | Si |
CT = Coliformes totales; T1, T2: Muestras comerciales consideradas como testigos
Los valores expresan promedios y desviación estándar UFC/g.
En lo que respecta al análisis e identificación de S. aureus, se observó que la mayoría de las muestras presentan valores superiores a los permitidos; el dato más alto registrado fue en la UP 14 con un valor promedio de 42 x 109 UFC/ml, las UP #1, #7 y #10 mostraron los valores más bajos de 10 x 101, 36 x 101 y 40 x 101 UFC/ml, respectivamente. Las dos muestras testigo y en la UP #2 esta bacteria está ausente. La mayor carga de coliformes totales (CT) se observó en la UP #12, con valor 40 x 109 UFC/ml y la menor carga en las UP #1 y #3 con valores de 12 x 101 y 29 x 101 UFC/ml, respectivamente. En contraste, en las muestras testigo y las UP #2, #5 y #8 este microorganismo estaba ausente.
Los resultados del análisis de Salmonella spp muestran que esta bacteria estuvo presente en la mayoría de las muestras, principalmente en aquellas donde no hay pasteurización de la leche. Por otro lado, las UP #1, #2 y #4 y las muestras testigo, hubo ausencia de este microorganismo.
Productos lácteos (queso)
Los resultados del análisis microbiológico de las muestras de queso se muestran en el Cuadro 4. De inicio es importante mencionar que se detectó la presencia de S. aureus en la mayoría de las muestras recolectadas en las UP visitados. Las UP donde se registró la mayor carga de este microorganismo fue en la #13 y #15 donde la carga microbiana correspondió a 32 x 109 y 63 x 109 UFC/g en queso elaborado con leche de vaca y cuajo artificial. En contraste, las UP #1 y #10 fue donde se obtuvo la menor carga microbiana con valores de 23 x 101 y 32 x101 UFC/g. Además, las muestras testigo y la UP #5, tuvieron ausencia de esta bacteria.
El análisis de CT, las UP #6 y #15 presentaron los valores más altos de 13 x 109 y 26 x 109 UFC/g, respectivamente, donde lo resaltante de estos resultados es que la primera UP utiliza cuajo artificial y la segunda cuajo natural. En contraste, la UP #10 fue el que presentó el dato más bajo de carga de CT de 74 x 101 UFC/g. Además, en las muestras de queso testigo y la UP #5, presentaron ausencia de CT.
Cuadro 4: Análisis microbiológico de muestras de queso y tipo de cuajo que se emplea en las unidades de producción
Unidad de producción | S. aureus | CT | Salmonella spp | Tipo de cuajo |
1 | 23x101±6x10 | 32x103±1x102 | Presente | Artificial |
2 | 83x105±2x104 | 70x103±9x102 | Presente | Natural |
3 | 18x103±1x102 | 16x105±6x104 | Presente | Natural |
4 | 21x102±1x10 | 24x108±1x108 | Presente | Natural |
5 | Ausente | Ausente | Presente | Artificial |
6 | 41x103±1x102 | 13x109±1x108 | Presente | Artificial |
7 | 60x104±2x104 | 28x103±2x102 | Presente | Natural |
8 | 87x103±6x102 | 38x103±3x103 | Presente | Artificial |
9 | 31x104±1x103 | 17x104±1x103 | Presente | Natural |
10 | 32x101±8x10 | 74x101±5x10 | Presente | Natural |
11 | 10x102±1x101 | 32x105±2x104 | Presente | Natural |
12 | 12x102±1x101 | 49x105±1x104 | Presente | Natural |
13 | 32x109±2x108 | 48x106±2x105 | Presente | Natural |
14 | 19x105±3x104 | 11x102±1x101 | Presente | Natural |
15 | 63x109±1x108 | 26x109±3x108 | Presente | Natural |
T1 | Ausente | Ausente | Ausente | Artificial |
T2 | Ausente | Ausente | Ausente | Artificial |
CT = coliformes totales; T1, T2= muestras comerciales consideradas como testigos
Los valores expresan promedios y desviación estándar UFC/g.
En la determinación de Salmonella spp, se observó presencia en todas las muestras de las UP analizadas, tal como se muestra en el Cuadro 4. Finalmente, solo las muestras de queso comercial presentaron ausencia de Salmonella spp.
Discusión
Los resultados del análisis fisicoquímico en el clúster I (muestras de leche de cabra) los valores en porcentaje son muy similares a los reportados para cabras Saanen en México(18) . Además, Salinas-González et al(19) señalan que dichos valores varían con respecto al tiempo, siendo más altos en el mes de septiembre. Estudios acerca de los factores que afectan la estabilidad del punto de congelación de la leche, señalan que la disminución del punto crioscópico está relacionado con un mayor contenido de lactosa y sales (calcio, fósforo, magnesio), así como al paso del tiempo (días) después del parto(20,21).
En cuanto a la calidad fisicoquímica de la leche de los clústeres II, III y IV (muestras de leche), los tres grupos están dentro de los datos de referencia de la NOM 155(22). Álvarez-Fuentes et al(23) mencionan que las explotaciones lecheras en pequeña escala localizadas en el sur de Ciudad de México, enfrentan el desafío de producir leche en cantidad y calidad; al respecto, los autores señalan que la calidad de la leche es diferente de acuerdo a la época de año (periodo seco, lluvias e invierno), los resultados de calidad de leche (grasa, proteína, lactosa y sólidos totales) que registraron en la época seca son muy similares a los obtenidos en este trabajo.
En este estudio se tomaron muestras de leche y queso de queserías locales para analizar las cargas microbianas patógenas. Además, se hizo una solicitud y cotejo de registros de las enfermedades causadas por el consumo de lácteos del año 2018 del Hospital Básico Comunitario de Salinas (comunicación personal, Dra. Sugey Bastidas Gastelum, directora), y la respuesta fue que el hospital sólo le da seguimiento a los casos de brucelosis (4 casos en ese año) debido a que es considerada como primordial por Vigilancia Epidemiológica, otras enfermedades causadas posiblemente por Escherichia coli, Staphylococcus aureus y Salmonella en lácteos y otros alimentos no las analizan debido a que no cuentan con laboratorio propio para procesamiento de muestras.
Para leche fluida, la NOM 243(9) indica que las cargas máximas permitidas para coliformes totales y S. aureus deben ser ≤10 UFC/ml por siembra directa, mientras que Salmonella debe estar ausente. Los bajos conteos de microorganismos en las UP 1, 5 y 10 puede deberse a que estas unidades fueron las únicas que cuentan con instalaciones exclusivas para el manejo de leche y proceso de elaboración de queso, así como a mantener medidas de higiene (uso de cofia, cubrebocas, botas y limpieza de equipo, piso y utensilios); a pesar de estas prácticas, las instalaciones no cuentan con puertas de cierre hermético que proteja de la entrada de polvo. En el Cuadro 3 se observa que en varias UP no se cumple con la normatividad, esto puede deberse a que la leche no es pasteurizada por la falta de equipos, conocimientos de tiempos y temperaturas de pasteurización y a la influencia al estado de salud de los animales, limpieza durante la ordeña, utensilios de ordeña y lugar de almacenamiento de la leche. En un trabajo realizado por Fuentes-Coto et al(24) se analizó la carga microbiana de leche orgánica, se detectó la presencia de bacterias mesofílicas y coliformes en leche y productos lácteos, donde las cantidades de UFC/ml estaban por encima del límite permitido.
Por otro lado, Álvarez-Fuentes et al(23) mencionan que la presencia de bacterias mesófilas y conteo de células somáticas están relacionadas con el tipo de limpieza que se les realiza a las ubres (tradicional, parcial y completo); sin embargo, en cuanto a la carga microbiana, aun cuando en el trabajo se describen bajos conteos de UFC/ml, no se especifica las especies de microorganismos.
A pesar de que el análisis microbiológico en la leche revela que las cargas microbianas son bajas en algunos establos, en algunos casos las muestras de queso fresco presentaron cargas microbianas superiores a lo permitido por la NOM 243(9), establece para CT un máximo de 100 UFC/g, S. aureus un máximo permitido de 1,000 UFC/g, y Salmonella spp debe estar ausente en 25 g de muestra.
Uno de los factores de las altas cargas microbianas detectadas en este estudio se debe probablemente a que en la UP #15 se utiliza como agente coagulante, cuajo natural fermentado en condiciones no estériles. En las entrevistas que se realizaron a los productores, estos comentan que el uso de cuajo natural se debe principalmente a que éste le impregna sabores y aromas deseables por los consumidores de queso fresco. Los resultados del Cuadro 4, son similares a los reportados en otras zonas productoras de queso en México, algunos autores(25) reportan para CT conteos de 9.27 log10 UFC/g y Salmonella presente en queso fresco. El queso de Aro que se comercializa en el municipio de Teotitlán de Flores Magón, Oaxaca, México, presentó conteos de 6.94 para CT, 6.74 para E. coli, 5.76 log10 UFC/g para S. aureus y Salmonella estuvo presente, en consecuencia, ninguna muestra analizada cumple con la normativa(26). También, el queso botanero artesanal del noroeste del Estado de México, presenta serias deficiencias en su calidad microbiológica, ya que los conteos sobrepasaban los límites de patógenos permitidos(27). En los hallazgos de este trabajo, únicamente los resultados de las muestras testigo cumplen con la normatividad. Por otro lado, la UP #5 cumple parcialmente en cuanto a conteos de CT y S. aureus. Sin embargo, hay presencia de colonias de Salmonella, lo cual se asocia a la utilización de leche no pasteurizada(25). En otras regiones geográficas como en Cajamarca, Perú, se analizó queso fresco industrial de seis empresas, bajo las directrices descritos en la Norma Sanitaria de criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano de ese país. En los resultados, destacan que todas empresas cumplen con lo establecido por la norma para Salmonella spp, ya que todas las muestras mostraron ausencia, respecto a otros agentes patógenos, sólo una empresa presenta mejores condiciones microbiológicas para la elaboración de queso fresco(28). Lo mismo ocurre en Egipto y países de Medio Oriente con los quesos suaves (Domiati), donde también presentan cargas de bacterias aerobias S. aureus, CT, E. coli y levaduras(29). En el norte de Irán el queso Kurdo, en nombre a la región donde se produce (Kurdistan, Irán), es un queso preparado con leche bronca de vaca u oveja, las cargas de microorganismos patógenos en los primeros días son muy similares a las cargas encontradas en este estudio; se encontró presencia de Salmonella, E. coli de 5.27 log10 UFC/g y 8.22 log10 UFC/g para CT. Además, señalan que la maduración del queso (60 días), las cargas disminuyen significativamente debido a la presencia de bacterias ácido lácticas(30).
La presencia de microorganismos patógenos en establos lecheros se debe a varios factores, por ejemplo, Salmonella está presente en otras especies animales domésticos como cerdos y aves de corral que pueden infectarse debido a que están dentro de la unidad de producción, en el ambiente por el manejo de estiércol y que su importancia radica en que puede sobrevivir por periodos prolongados de tiempo en el ambiente y ocasionar salmonelosis en humanos(31,32). Por otro lado, Staphylococcus aureus es un patógeno muy común que causa la enfermedad de mastitis en vacas lecheras, al respecto, si la leche no se pasteuriza esta bacteria se puede llegar a encontrar hasta en los tanques de almacenamiento de la leche(33). En el caso de coliformes, Van Kessel et al(34) señalan que estos microorganismos enteropatógenos son muy persistentes en los establos lecheros; su origen es el intestino de los animales, así como sus heces fecales y agua contaminada con estiércol, con riesgo alto de contaminación de la leche y de los tanques de almacenamiento. Los autores descritos concuerdan en señalar que la mala calidad sanitaria de los productos lácteos en toda la cadena de producción de leche y queso es un problema de salud, ya que estos pueden ser un vehículo de transmisión de enfermedades alimentarias, por su elevado contenido de: E. coli, Listeria monocytogenes, S. aureus, Salmonella y posiblemente Brucella spp(26,35,36). Por lo que recomiendan mejorar la calidad a nivel de establo con medidas higiénicas de ordeño, establecimiento de una cadena de frío, transporte adecuado y buenas medidas sanitarias de la leche, tales como; higiene de las instalaciones donde se elaboran los quesos, uso de ropa adecuada, uso de agua potable, lavado de utensilios, mesas y desinfección de manos(25).
Conclusiones e implicaciones
De acuerdo a los resultados de los análisis a las muestras de leche y queso, la mayoría de las unidades de producción no cumplen con estándares de calidad en los productos lácteos, debido a que no tienen buenas prácticas de higiene a lo largo de todo el proceso de elaboración, por lo que es necesario implementar acciones que concienticen a los productores a tomar mejores medidas de sanidad para disminuir las posibles fuentes de contaminación y que no represente un riesgo a la salud de los consumidores, provocando posibles enfermedades gastrointestinales, principalmente. Es necesario realizar más estudios en el proceso de elaboración de queso fresco, tales como, toma de muestras de utensilios, análisis del cuajo natural y realizar algún proceso de esterilización del cuajo natural por medios físicos. Así como, realizar talleres a los productores de buenas prácticas de elaboración de productos lácteos.
Agradecimientos
Los autores agradecemos a los productores por otorgarnos las muestras y al Fondo de Apoyo a la Investigación C18-FAI-05-57.57 UASLP.
Declaración de conflicto de intereses
Los autores manifestamos que no existe conflicto de intereses.
Literatura citada: